截止2024年底,Team-NB协会成员公告机构数量达43家,此次发布的“2024年公告机构行业调查”汇编来自41个公告机构的数据,该调查结果的详情解读如下↘
1.公告机构发证数量规模
Team-NB根据“法规和指令下所颁发证书”的数量,定义的公告机构规模明细:
大规模:1000 张以上证书,占比17%;
中等规模:300至1000张证书,占比32%;
小规模:少于350张证书,占比51%。
2.法规证书数量的进展
·MDR申请和证书(质量管理体系+产品)
2024年MDR证书数量为9683张,申请数量为20935张。
该数据对比2025年2月“支持监测欧盟市场医疗器械可用性的研究”结果,Team-NB 数据涉及2024年12月颁发的证书,Team-NB占签发总数的79%,收到的申请占比73%。
·IVDR 申请和证书
2024年IVDR证书数量为1609张,申请数量为2249张。
Team-NB占签发总数的100%,收到的申请占比94%。
3.MDR和 IVDR法规下不同合格评定模块间的证书分布
4.向MDR和IVDR的特殊过渡
以下是“发证和申请方面向两项法规请求特定过渡”所收到的反馈:
需注意:根据附件XVI提交的资料显著增加,已增至以前的2倍多。颁发附件XVI证书的数量,则已增至以前的4倍多。
AI/机器学习器械的提交数量稳定,颁发的证书数量增长20%。
值得关注的是:D类器械申请数量明显增加,增长73%,D类器械证书颁发数量增加170%。
5.制造商数量
证书持有者中,欧盟医疗器械厂商为6223家,非欧盟医疗器械厂商为6878家;欧盟体外诊断器械厂商为505家,非欧盟体外诊断器械厂商为577家。
6.完整性检查
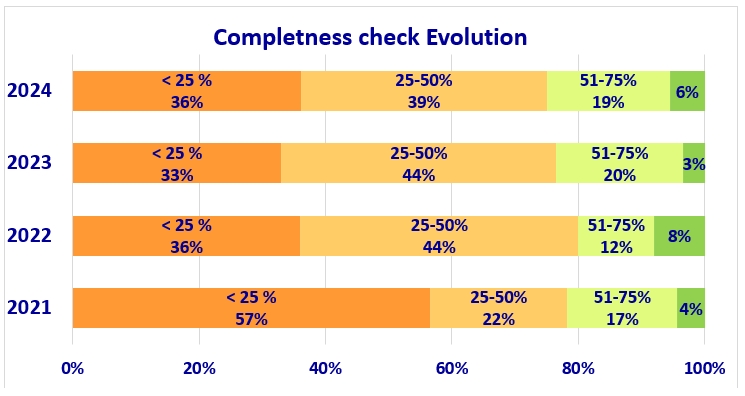
根据法规要求,公告机构在审核内容之前必须确保已收到完整的技术文档(有时称为完整性检查)。数据显示,所收到的技术文档的完整性正逐渐提升。
依旧有75%的提交文档完整性低于50%。“支持监测欧盟市场医疗器械可用性的研究”结果同样表明:公告机构反馈称23%的提交完成率超过50%。
MDR\IVDR拿证难度高&要求严&时间久√可信赖的合规助手是拿证成功关键!
√选择久顺就是选择成功!始创于1996年,西班牙\荷兰\英国\美国\中国均设公司,近30年全球合规技术专家。提供全程高效的欧盟合规服务:√CE注册取证√技术文档编写 √合规策略 √体系辅导 √上市后监督咨询 √近20年资深欧代 √编撰临床方案设计\临床试验方案 √收集\整理\分析试验原始数据并出具临床试验报告等。





