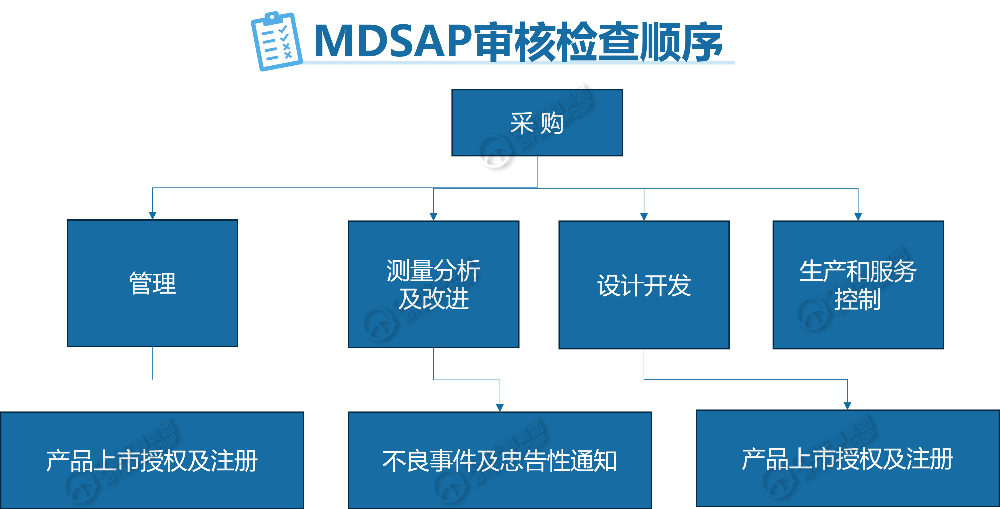
一、MDSAP审核顺序
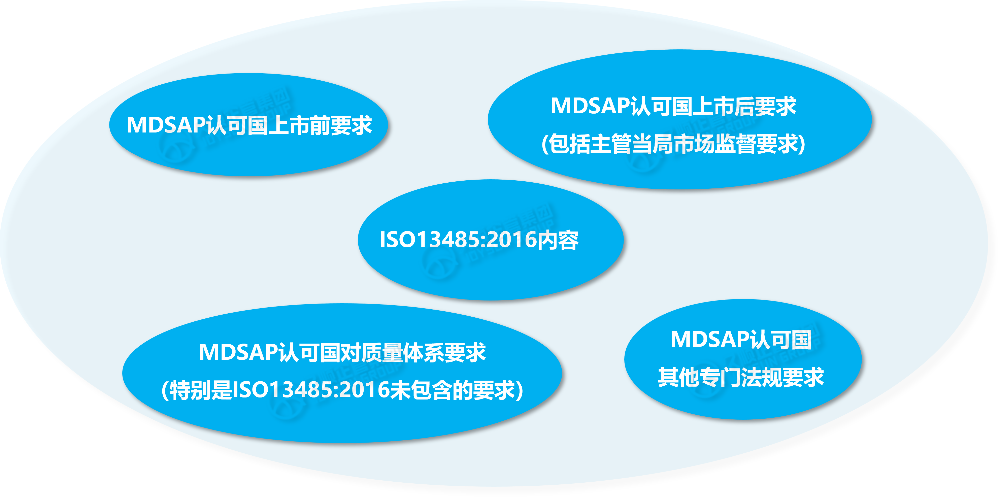
二、MDSAP审核内容分解
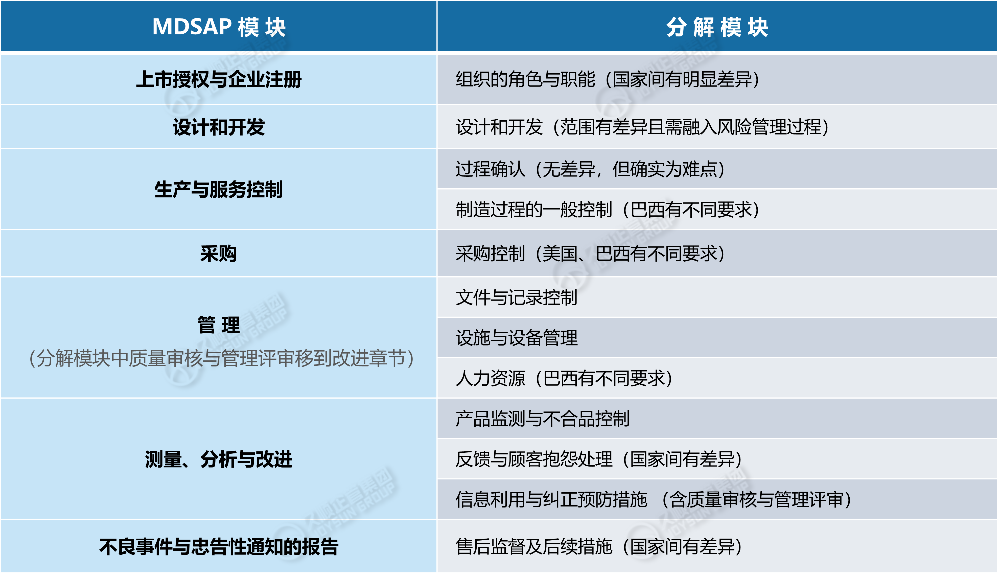
1. 组织的角色与职能
· 拟上市或已上市产品应正确进行风险分级
· 必须符合规定的符合性评定程序(产品上市途径)
· 企业履行的职能应与登记的角色保持一致
· 设计开发的删减应做到有法可依
· 过程(如灭菌)实施外包,不代表减少发包人法律责任
2. 设计与开发
· 设计开发应包括制造过程、检测方法、工具设备及生产环境条件
· 放行销售的产品应与授权上市的产品保持一致(如技术/工艺/适应症)
· 设计变更应开展法规符合性的评审
· 设计开发确认应包括软件确认(若适用)
· 某些方法应进行确认,如某些检测方法
· 设计开发过程是风险管理的主要环节
3. 过程确认
· 充分识别并确认特殊过程
· 根据惯例对某些过程进行验证(如清洗过程)
· 过程确认应与产品确认相融合
4. 过程控制
· 必须对已确认的特殊过程参数进行监测
· 必要时应对环境条件、人员卫生进行控制(巴西尤为如此)
· 必要时应控制污染(特别是生物污染)
· 必须控制器械标记的使用
5. 采购控制
· 采购范围扩展至设备、过程、服务(如培训)
· 物料、设备、过程、服务的供应商,应区别采用不同的控制方法
· 应充分考虑供应商及其产品的合规性
6. 文件与记录控制
· 单独建立MDR、DHF、DHR、CCF(顾客抱怨档案)
· 文件和记录的保存期应满足产品相关法规和标准要求
· 上市申请文件及上市后文件资料是重要的质量体系文件
· 文件更改应充分识别所引发的影响
7. 设施与设备管理
· 提供特殊条件的基础设施应予以验证,如空气净化系统、工艺用水制备系统
· 质量管理、生产、产品监测三大工具软件应予以确认
· 无国家或国际标准物质的计量器具,应自建标准、校准并保证自建标准可再现
· IVD校准品和质控品应具备赋值过程且可溯源
8. 人力资源
各国要求无明显差异,但巴西要求评价咨询顾问资质、日本要求任命品质工程经理。
9. 产品监测与不合格品控制
各国无明显差异,但需注意产品合格与产品放行之间的概念差异。
不合格品包括返回组织的器械。
10. 反馈与抱怨处理
· 应区分反馈和抱怨(投诉是反馈的一部分)
· 抱怨处理应考虑调查、报告主管当局、启动纠正措施的需要
· 切勿混淆抱怨处理、纠正措施、日常售后服务(如维修)
· 抱怨处理可能涉及专门法规,如美国21CFR806要求
· 抱怨处理与改进过程、售后监督及主管当局的市场监管过程密切关联
11. 信息利用与纠正预防措施
· 充分利用顾客反馈(含抱怨和服务)、质量审核、过程监测、产品监测、数据分析、管理评审、内审及其他信息
· 纠正预防措施的制定应考虑风险管理因素
· 改进措施实施前后均应进行充分的评价
· 应将改进措施上传下达
12. 上市后监督及后续措施
· 实施上市后监督
· 报告不良事件或事故
· 追踪产品(植入及生命维持/支持器械)
· 重启风险管理过程
· 处理相关产品(撤市、现场纠正、召回等)
MDSAP高速通关: 务必搭乘#久顺号列车#
√ 建立运行MDSAP体系+辅导通过公告机构审核,历来是久顺优势咨询服务项目。
√【久顺企管】近30年全球合规技术专家、资深体系服务专家,能力&资历俱佳的技术团队,成员超80%本科\硕士\博士,普遍海外留学经验,全程高效MDSAP体系辅导合规服务\培训\模拟审核\陪同审核\不符合项关闭\辅导取得MDSAP体系证书。