重 要 性
■ 为确保医疗器械质量及临床使用安全有效,必须对其生产过程所涉及非活性材料作生物相容性评价,用于生产工艺过程监控和最终产品放行。
■ 众所周知,风险管理是保障医疗器械安全的重要质量管理活动,生物相容性风险则是医疗器械风险管理的重要组成,在产品全生命周期中都少不了它的身影,良好的生物相容性成为了医疗器械安全有效应用的先决条件。
■ 再放眼医疗器械注册过程,除关注产品性能测试外,产品生物相容性测试不容忽视。不同于性能测试关注器械物理安全性,生物相容性则是关注器械制造材料安全性。可见,生物相容性评价研究是医疗器械产品研发和注册技术审评的一大重点。
本期,久顺企管为您全维度解读其要点。
两大分类
■ 血液相容性:材料用于心血管系统,与血液直接接触,主要考察与血液的相互作用。
■ 血液相容性要求:抗血小板血栓形成、抗凝血性、抗溶血性、抗白细胞减少性、抗补体系统抗进性、抗血浆蛋白吸附性、抗细胞因子吸附性。
■ 组织相容性(一般生物相容性):材料与心血管系统以外的组织和器官接触,主要考察与组织和器官的相互作用。
■ 组织相容性要求:细胞黏附性、无抑制细胞生长性、细胞激活性、抗细胞原生质变化性、抗炎症性、无抗原性、无诱变性、无致癌性、无致畸性。
标准与原则
生物相容性的评价标准为ISO 10993系列标准、GB/T 16886系列标准。
■ 生物安全性原则:安全、科学、有效。
目的在于消除生物材料对人体器官的破坏性,比如细胞毒性和致癌性。
由于生物材料对宿主(使用者)而言为异物,所以在宿主(使用者)体内会产生某种应答或出现排异反应。生物材料如需确保安全,至少需使得发生的反应能被使用者接受,不会产生有害作用。
■ 生物功能性原则:相容、安全、有效
生物功能性是指在特殊应用中“能够激发宿主(使用者)恰当应答”的能力。
随着对生物材料生物相容性的不断深入研究,人们发现不仅需要对生物材料的毒副作用开展评价,还应进一步评价生物材料对生物功能的影响。
试验项目
可按照器械接触人体的部位(如皮肤\黏膜\组织\血液)、方式(直接接触\间接接触或植入)、时间(短时\长期\持久)、用途进行分类。一般生物相容性试验项目如下表↓
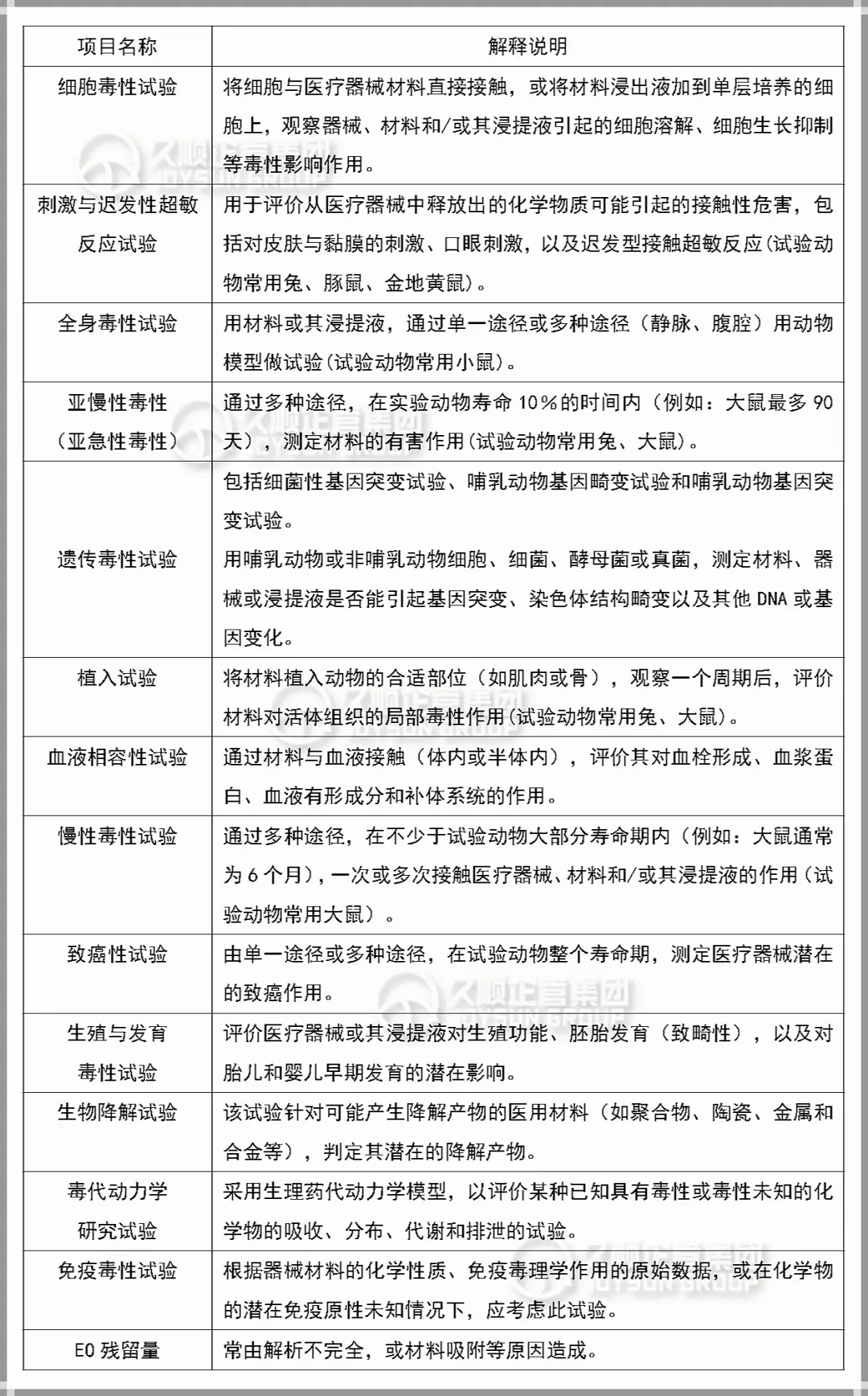
注意:虽然测试的项目较多,但并非所有产品都需要进行全套测试项目,应主要根据产品使用方法及产品作用性能共同决定所需测试项目。
> 生物相容性评价服务,久顺是您值得托付的上选!
√【久顺企管集团】近30年医械合规服务专家,配备海内外专业技术团队,专注无菌\非无菌\植入\有源\体外诊断等医疗器械领域,擅长质量体系GMP、产品注册、生产许可证、经营许可证、临床试验等项目,为医疗器械注册技术审评可提供:检测前标准识别;检测问题原因调查、分析和解决;注册技术文档的双语编写(中文/英文);合规培训支持与咨询等服务。




