以“一次性使用无菌尿道扩张器”为案例,分别拆解国内二类医疗器械的注册审查要求。
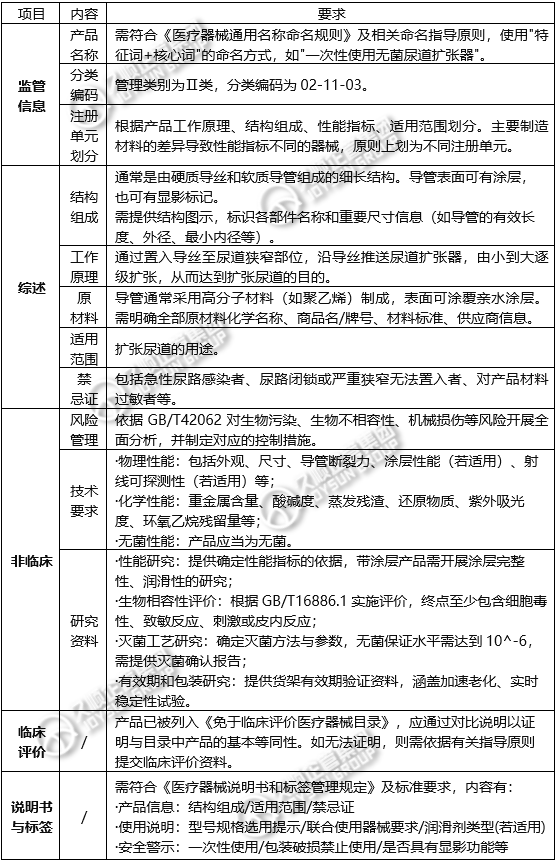
1.监管信息
·产品名称:应符合《医疗器械通用名称命名规则》及相关命名指导原则,采用"特征词+核心词"的命名方式,如"一次性使用无菌尿道扩张器"。
·注册单元划分:以产品的工作原理、结构组成、性能指标和适用范围为依据。主要制造材料有差异导致性能指标不同的,原则上划分为不同的注册单元。
2.综述资料
·结构组成:产品通常由硬质导丝和软质导管组成,为细长结构。导管表面可有涂层,亦可有显影标记。需提供结构图示,标识各部件名称和重要尺寸信息(如导管有效长度、外径、最小内径等)。
·工作原理:通过置入导丝至尿道狭窄部位,沿导丝推送尿道扩张器,从小到大逐级扩张,达到扩张尿道的目的。
·原材料:导管通常采用高分子材料(如聚乙烯)制成,表面可涂覆亲水涂层。需明确所有原材料的化学名称、商品名/牌号、材料标准及供应商信息。
·适用范围与禁忌证:
适用范围:用于扩张尿道。
禁忌证:包括急性尿路感染者、尿路闭锁或严重狭窄无法置入者、对产品材料过敏者等。
3.非临床资料
·风险管理:依据GB/T 42062对生物污染、生物不相容性、机械损伤等风险进行全面分析,并制定相应的控制措施。
·技术要求:
物理性能:包括外观、尺寸、导管断裂力、涂层性能(如适用)、射线可探测性(如适用)等。
化学性能:重金属含量、酸碱度、蒸发残渣、还原物质、紫外吸光度、环氧乙烷残留量等
无菌性能:产品应无菌。
·研究资料:
产品性能研究:提供性能指标确定依据,对带涂层产品需开展涂层完整性、润滑性研究;
生物相容性评价:依据GB/T 16886.1进行评价,终点至少包括细胞毒性、致敏反应、刺激或皮内反应;
灭菌工艺研究:明确灭菌方法和参数,无菌保证水平需达到10^-6,提供灭菌确认报告;
有效期和包装研究:提供货架有效期验证资料,包括加速老化和实时稳定性试验。
4.临床评价
产品已列入《免于临床评价医疗器械目录》,需通过对比说明证明与目录中产品的基本等同性。若无法证明,需按相关指导原则提交临床评价资料。
5.产品说明书和标签
说明书和标签应符合《医疗器械说明书和标签管理规定》及相关标准要求,内容包括:
·产品信息:结构组成、适用范围、禁忌证
·使用说明:型号规格选用提示、联合使用器械要求、润滑剂类型(如适用)
·安全警示:一次性使用、包装破损禁止使用、是否具有显影功能等。
>医疗器械注册,久顺是您不二之选! 近30年全球合规技术专家,专注无菌\非无菌\植入\有源\体外诊断等医疗器械领域,丰厚的产品注册、质量体系、临床试验等咨询管理和技术服务经验,护航产品全球畅行无阻!




