*上传EUDAMED?先过SRN这关再说!
欧盟医疗器械法规MDR和IVDR正式实施后,医疗器械制造商/授权代表/进口商和系统或程序包生产商必须在EUDAMED数据库中注册并获得单一注册号Single Registration Number(以下简称SRN),作为各经济运营商在欧盟EUDAMED及相关官方文件和报告中的身份标识,其号码结构为:国家代码+经济运营商角色代码+9位数字编码(如下图所示)。
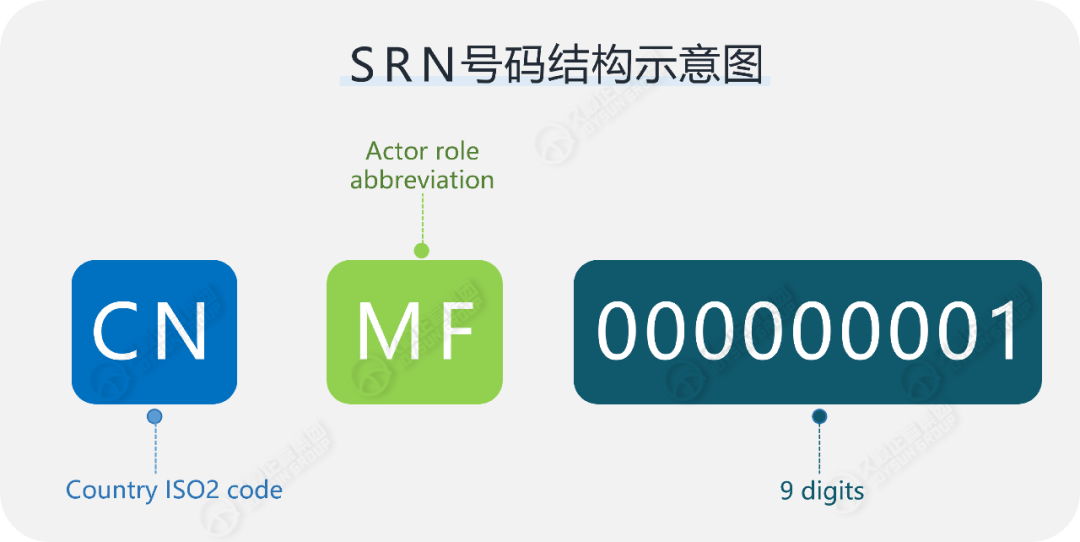
所有经济运营商均需通过EUDAMED的Actor注册模块提交相关信息完成申请。可见,掌握SRN申请流程是确保制造商符合欧盟合规要求的关键要素!本期有序详细讲解SRN申请流程,帮助制造商高效完成SRN注册操作,避免因申请流程不清或资料错误引发MDR或IVDR不合规风险。
*SRN申请完整过程(图解)
1. 访问以下网址:
https://webgate.ec.europa.eu/eudamed,首先使用邮箱创建EU账号。
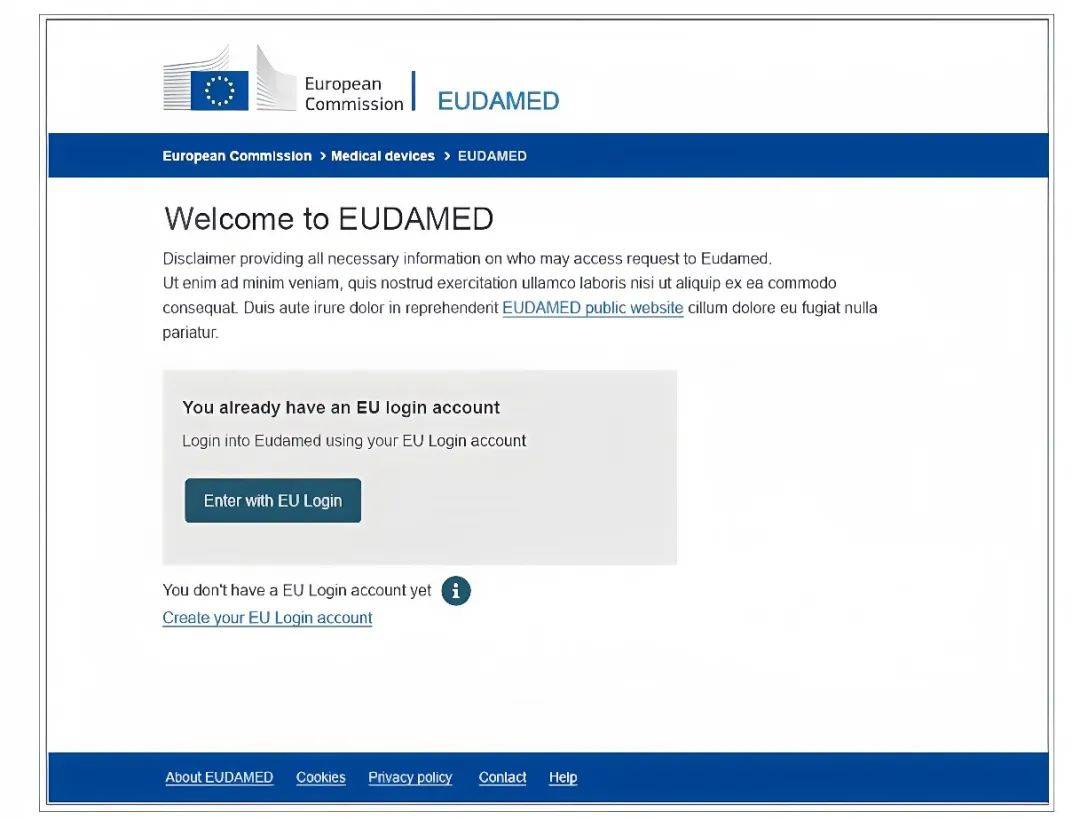
2. 注意:务必选择常用的公司邮箱地址,否则一旦丢失找回会变得特别麻烦!
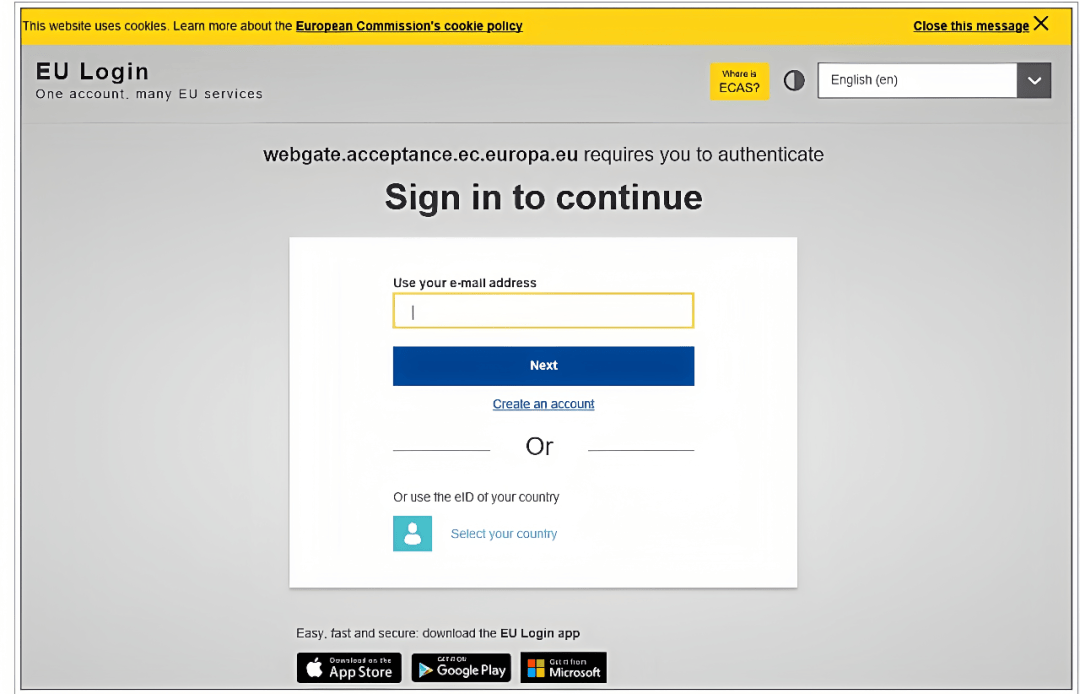
3. 注册成功后,邮箱将收到验证邮件,完成验证后再进入下方页面即可登录。
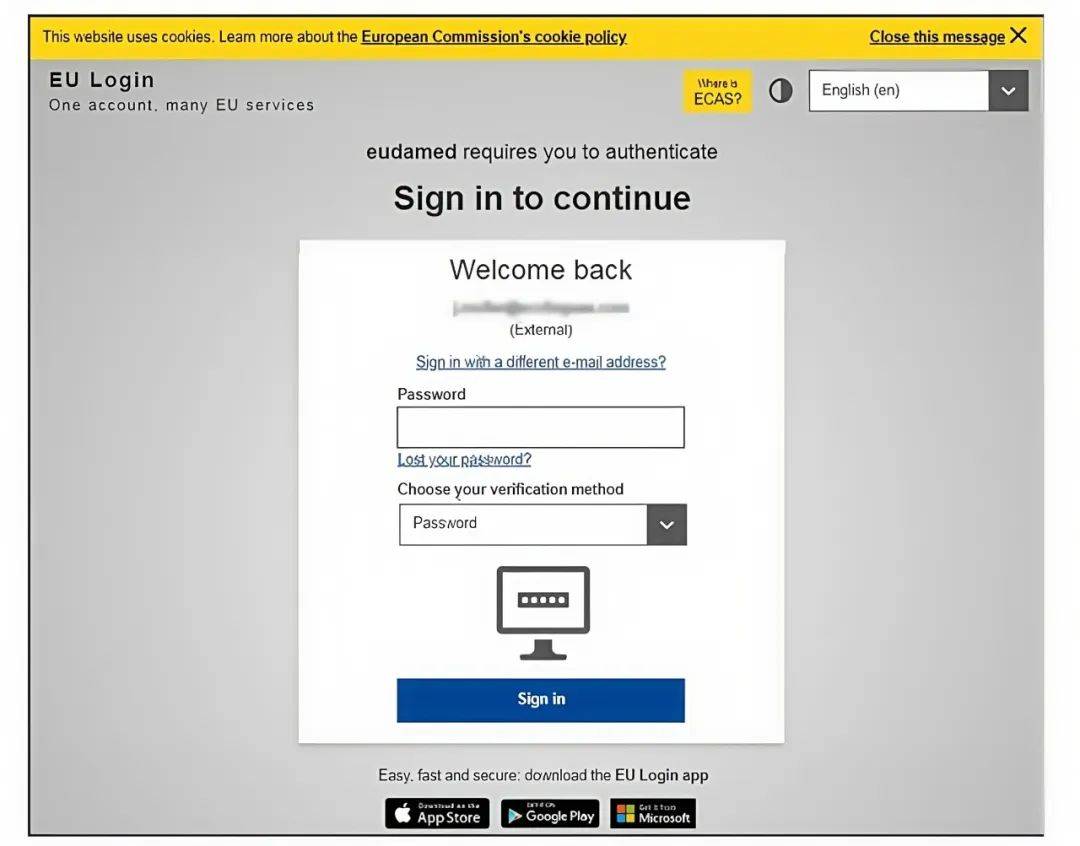
4. 登录后进入以下页面,左为“加入已有公司”,右为“新公司注册”。

5. 注意图中按钮,然后点击“下一步”。
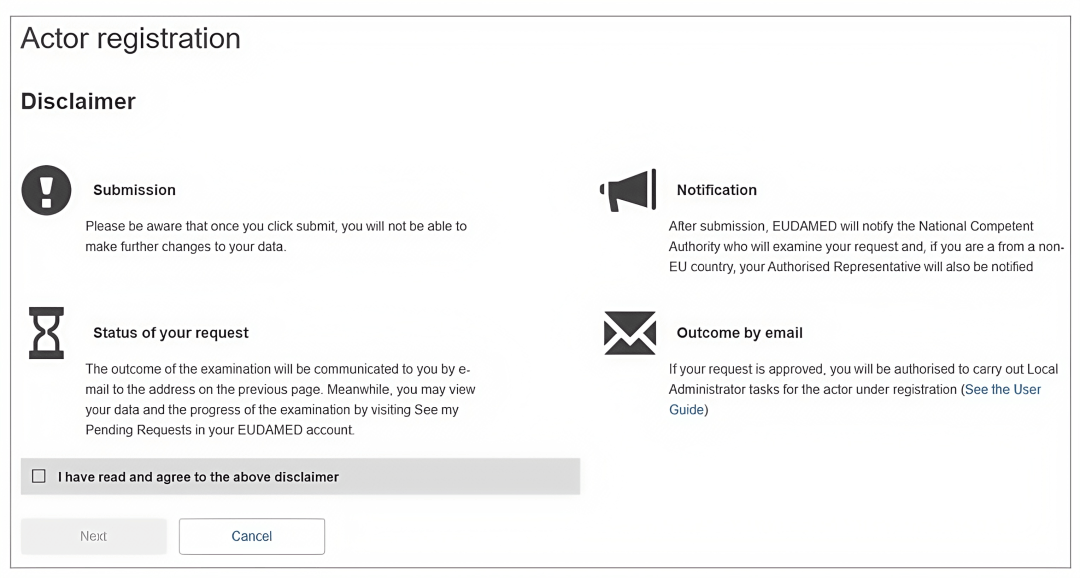
6. 选择“制造商信息”。
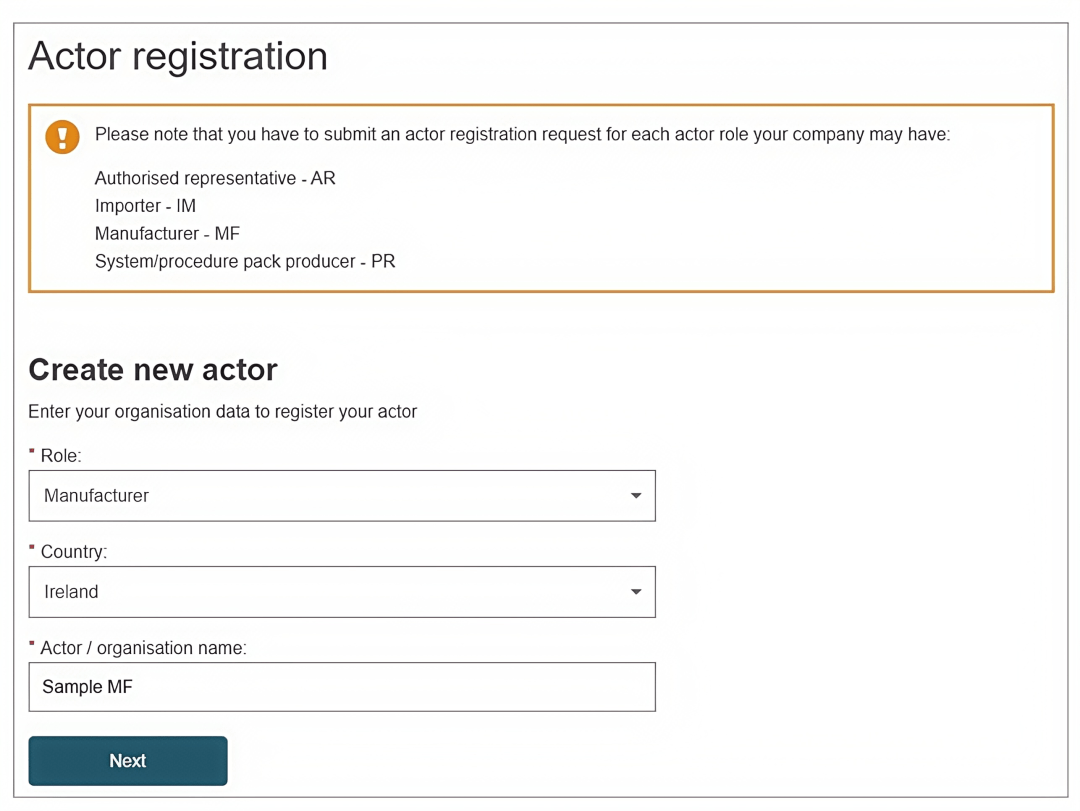
7. 输入“制造商信息”。
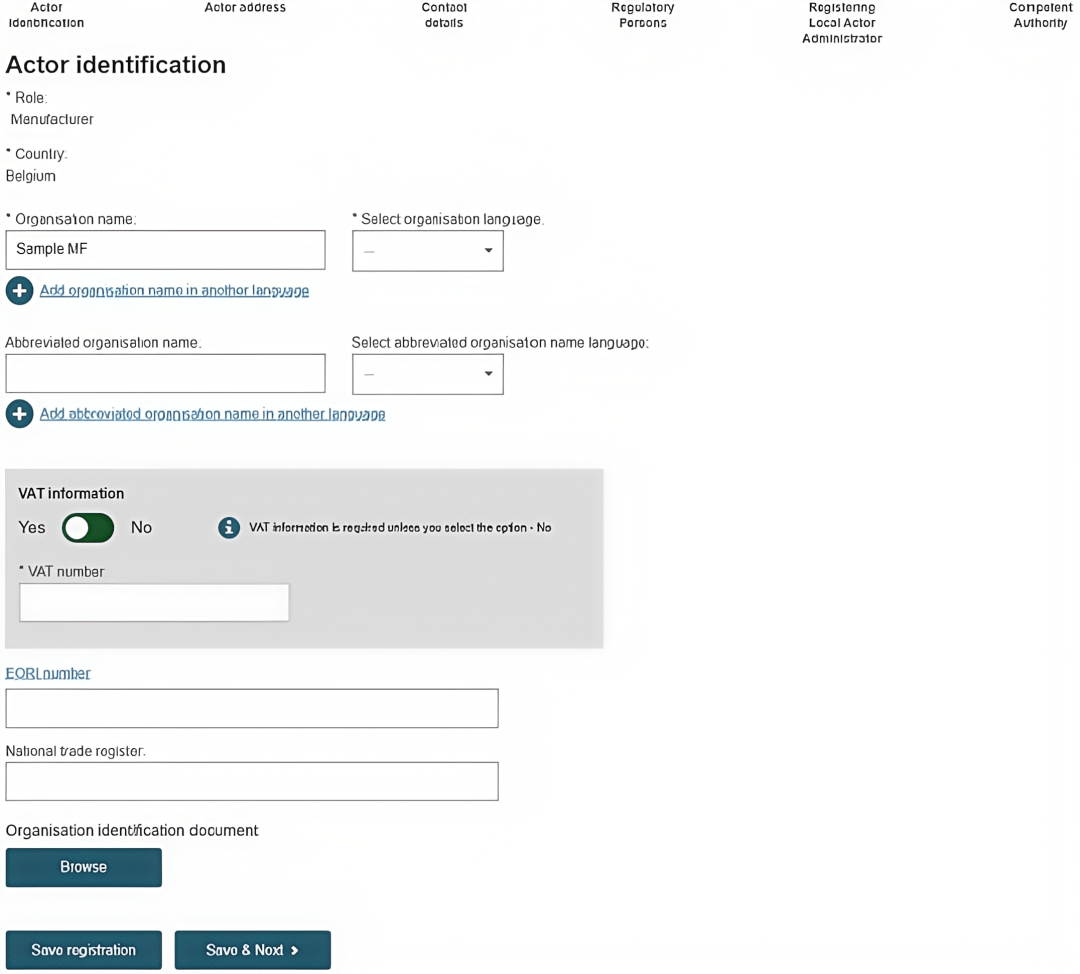
8. 输入“欧代信息”。
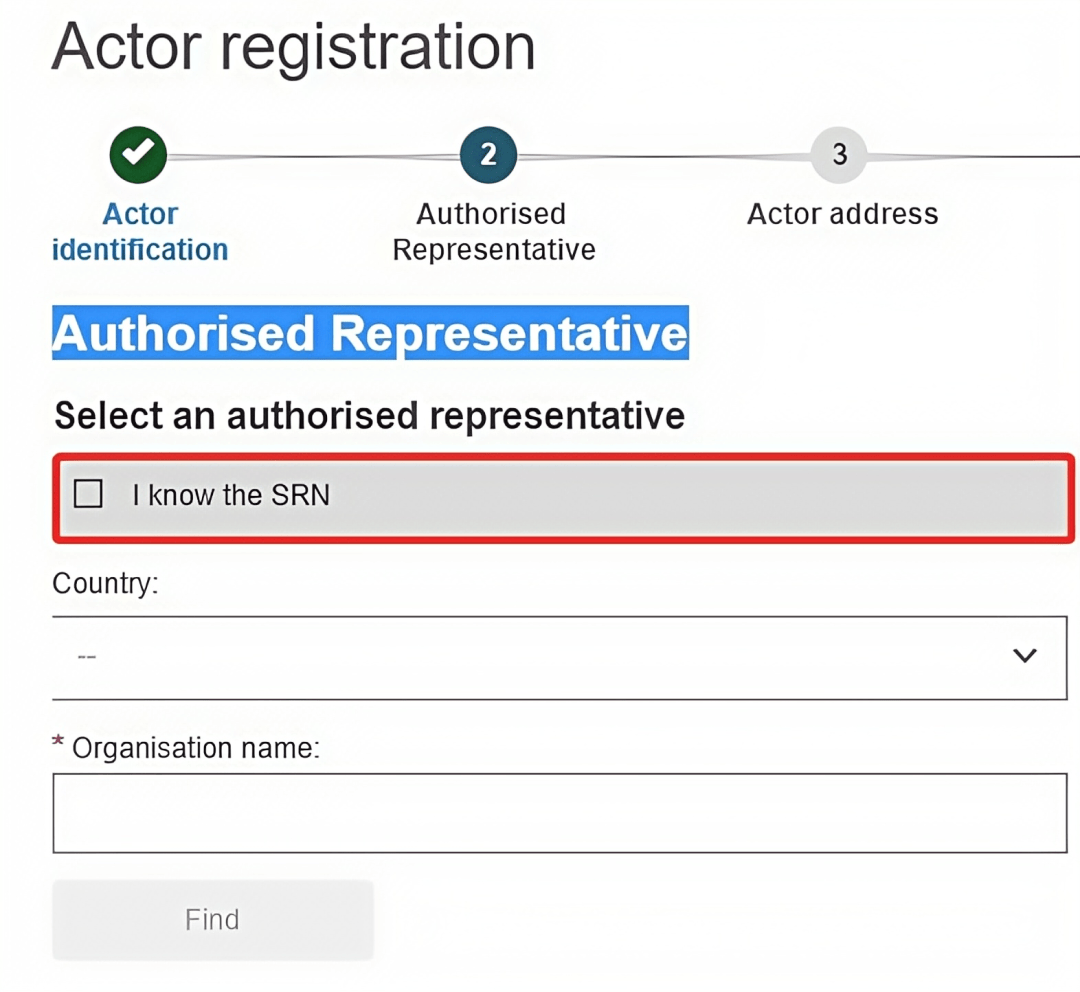


9. 填写“制造商地址”。
10. 输入“联系信息”。
11. 输入“法规负责人信息”。

12. 输入“LAA信息”。

13. 选择“主管当局信息”。
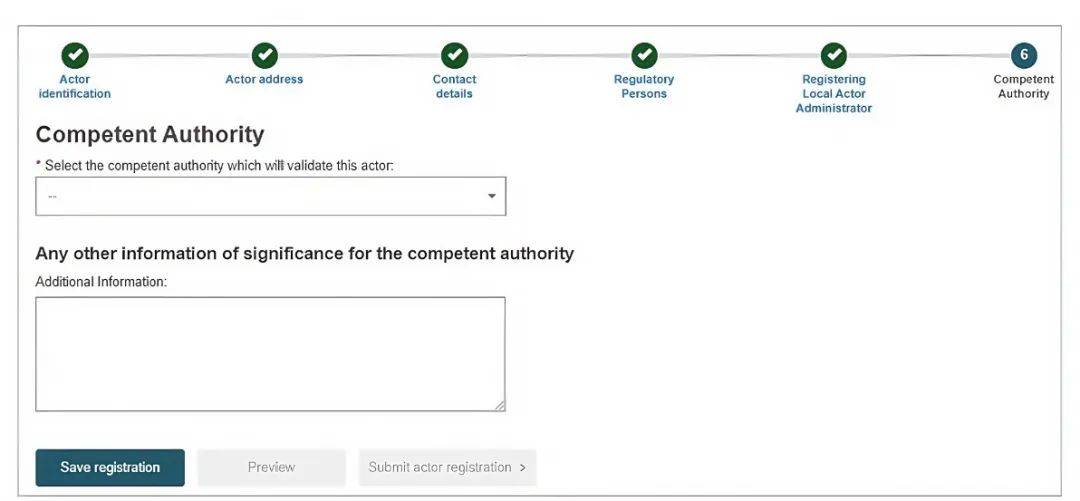
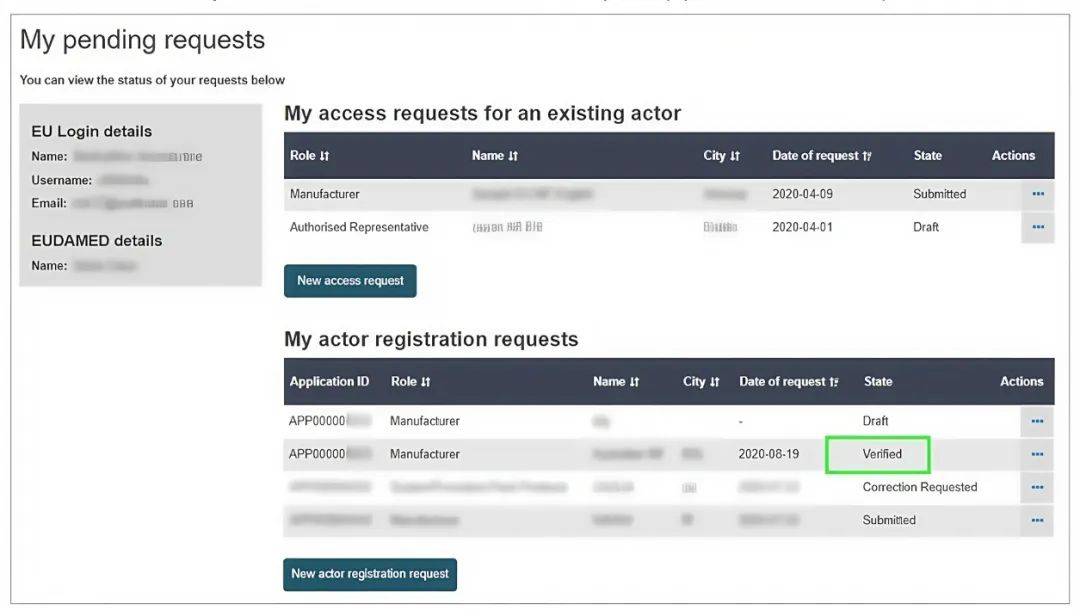
14. 当收到以下内容的邮件时,代表:已成功获取SRN!
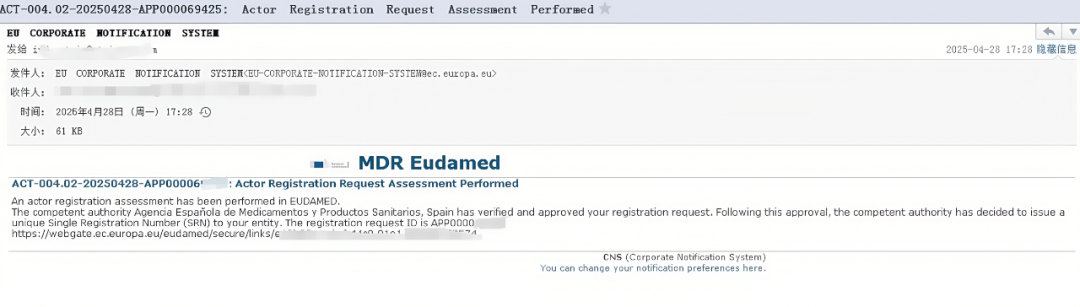
重要提示:只有获得SRN号并分配完权限后,才出现UDI-DI注册上传选项!
→为什么建议制造商尽快完成EUDAMED注册?
欧盟已官宣确定→2026年5月28日开始,强制推行EUDAMED医疗器械数据库的4大模块:经济运营商注册、器械唯一标识/器械注册、公告机构及证书 、市场监督,设置6个月的过渡期。
即便有过渡期作为缓冲,但企业仍必须明确:EUDAMED的注册上传,已成为维持欧盟市场准入资格的决定性条件。
久顺经常收到不少制造商的询问:客户纷纷要求我们注册EUDAMED数据库,否则双方交易将无法达成!
这些问题都可放心交给久顺!为您更快/更高效解决!具体服务包括但不限于:
√EUDAMED经济运营商注册;√欧盟UDI-DI申请;√EUDAMED数据库上传及指导;√UDI相关质量体系建立与维护……



