《欧盟注册那些事》第七集:这才是真正的定期安全更新报告!
定期安全更新报告PSUR(全称Periodic Safety Update Report)是医疗器械和体外诊断产品制造商的关键文档,也是制造商上市后监督和风险管理计划的关键组成部分,可对其产品的安全性和性能进行持续评估。
IIa、IIb、III类的医疗器械制造商,应定期安全性更新报告,由此可按照MDR附录III汇总:上市后监督数据的分析结论、所采取的纠正预防措施的描述。
一.PSUR的准确认知
根据PSUR相关指南,术语“器械”涉及器械型号,而不是“单个器械”,因为“单个器械”在“器械”证书所涵盖期间内的不同时刻投放市场。
根据第86(1)条和MDR附件III第2点,PSUR是制造商根据第83至86条起草的上市后监督技术文档的一部分。PSUR应以清晰、有组织、易于查找、明确的方式提出。PSUR应该作为独立的文档生成,可独立于支持文档进行评估。
PSUR应提供所有上市后监督活动的总体概述、根据器械上市后监督PMS计划而收集和分析的数据。
因此,PSUR的目标,并非复制上市后监督PMS计划所产生的数据和报告,而是总结所有结果和结论。
二.PSUR的涵盖内容
- 收益/风险的结论;
- 器械的销售数量;
- 器械的用户数量和特征;
- 器械的使用频率;
- 上市后临床跟踪的主要问题。
三.决策是否需要PSUR
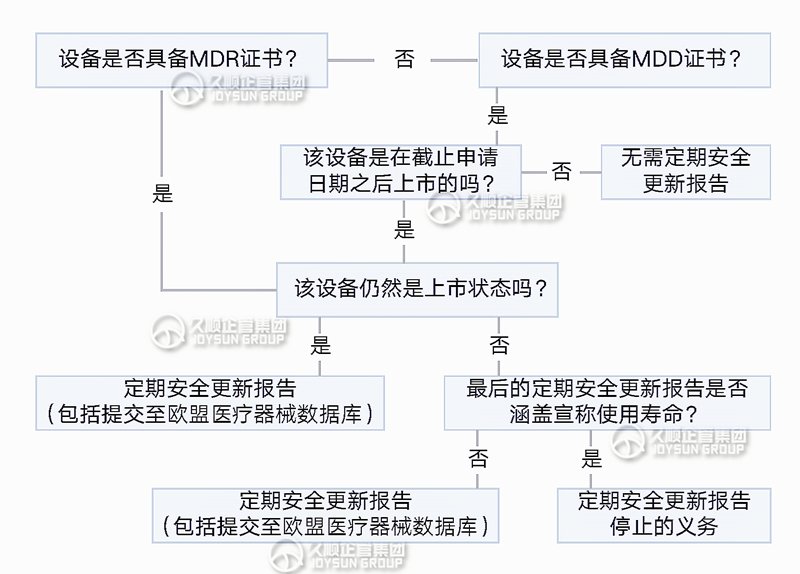
四.PSUR在不同分类下的要求
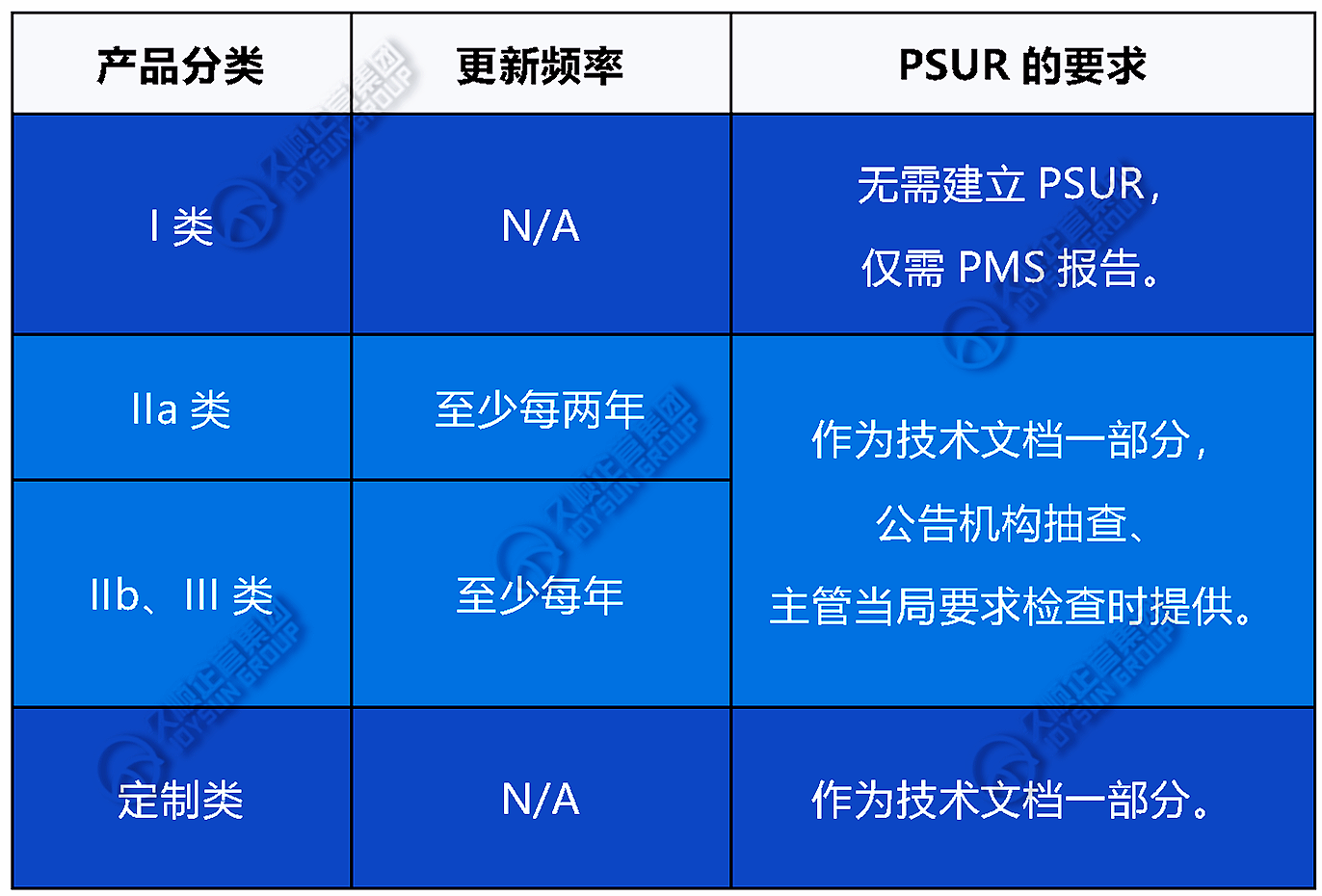
五.PSUR更新的终止
当器械(型号)的最后一个产品已投放市场、该(单个)产品到达预期寿命时,不再需要更新PSUR,换言之:器械(型号)的总体寿命已实现。
器械(型号)的总体寿命应包括:最后一个器械投放市场至该(单个)器械预期寿命结束的时间,为便于真正理解↓以下举实例进行说明:
例1:X光机可能无保质期,但应当有持续工作和保持预期安全的寿命。PSUR必须更新至最后投放市场产品的预期使用寿命结束为止。
例2:植入式装置的保质期可能为3年,但预期寿命为10年。在最后一个产品投放市场后,当保质期(3年)加上预期寿命(10年)即13年结束后,PSUR可以被终止。
→欧盟CE证书办理快·准·好的秘诀是什么?
[久顺企管集团]是您合规路上的加速引擎!始创于1996年,近30年全球合规技术专家,近20年资深欧代,荷兰\英国\美国\中国均设公司。
■ 呈献全程高效的欧盟合规服务:
√ 欧盟CE注册取证;
√ 技术文档编写;
√ 合规策略;
√ 体系辅导;
√ 上市后监督咨询等。
■ 已成功布局欧盟临床试验渠道,提供欧盟临床试验一站式CRO服务:
√ 临床方案设计、临床试验方案的撰写;
√ 与当地实验室/医院合作,安排客户试验产品合规开展临床试验;
√ 包括但不限于:收集\整理\分析试验原始数据并出具临床试验报告。









 沪公网安备 31011502005499
沪公网安备 31011502005499