FDA数据库查询的实用功能
对医械人而言,FDA网站堪称宝藏大全,其数据库囊括与医疗器械相关的各类实用信息。 例如:豁免510(K)产品,可在注册和列名模块,查询到已在FDA官网注册和列名的信息;510(K)路径上市产品,则可通过510(K)上市前通知数据库模块,查询到已获准上市产品的公开信息。 再如:医疗器械产品分类数据库(Product Classification)、医疗器械产品注册信息数据库(Registration & Listing)均会进行周更。 本期就将FDA产品分类和注册信息的数据库使用方法,手把手图文分解共享。
FDA数据库的登录
→ 方式 ①
1.输入正确的网站地址
2.首页下拉至"PRODUCTS WE REGULATE",点击“Medical Devices”,进入医疗器械专题页面。
3.页面下拉至“SEARCH MEDICAL DEVICE DATABASES”,找到注册和分类的数据库链接。
→ 方式 ②
1.首先在FDA官网右上角的“Search”中输入“Medical Device Database”。
2.该页面罗列FDA所有相关的数据库,包括本文之前已介绍的数据库。
分类数据库的查询
在分类数据库查询产品名,可查看产品代码、部分适用标准、产品分类等级。
下图以手术衣为例:
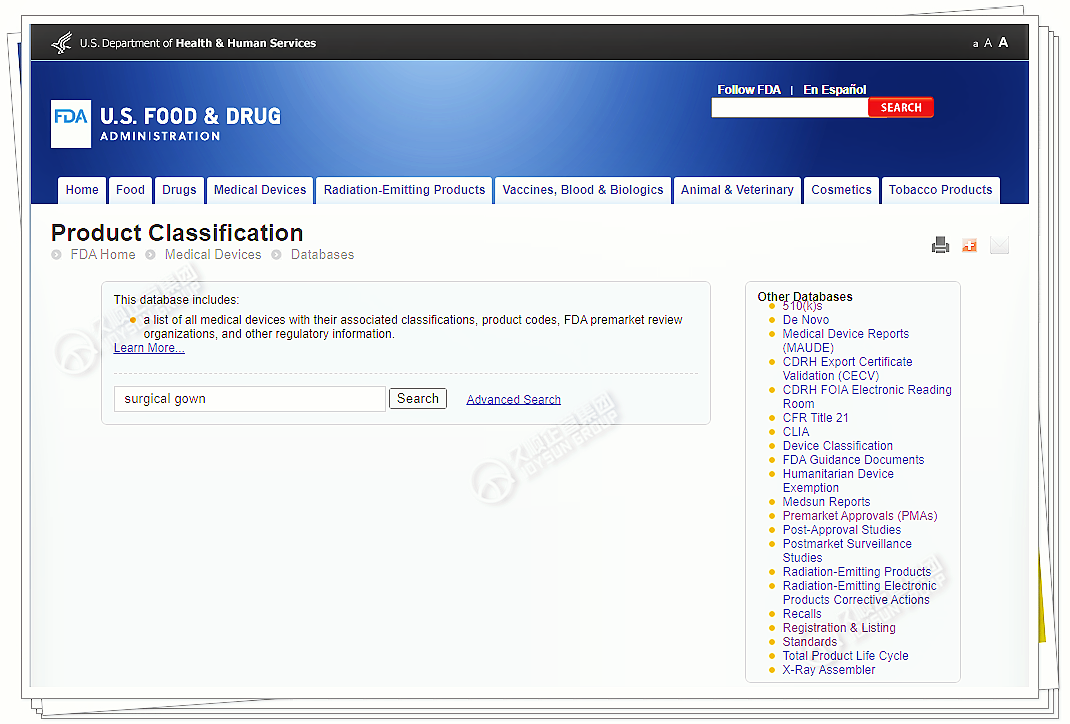
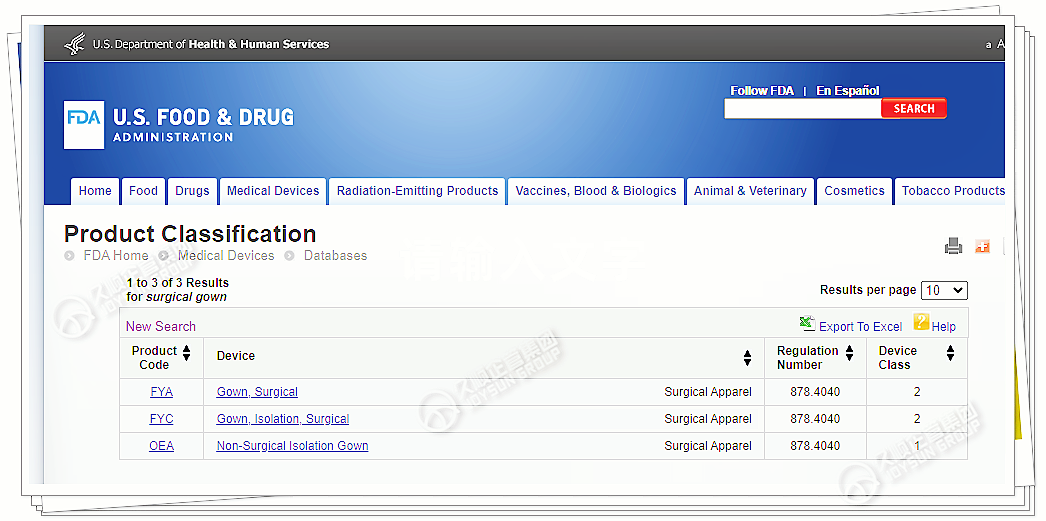
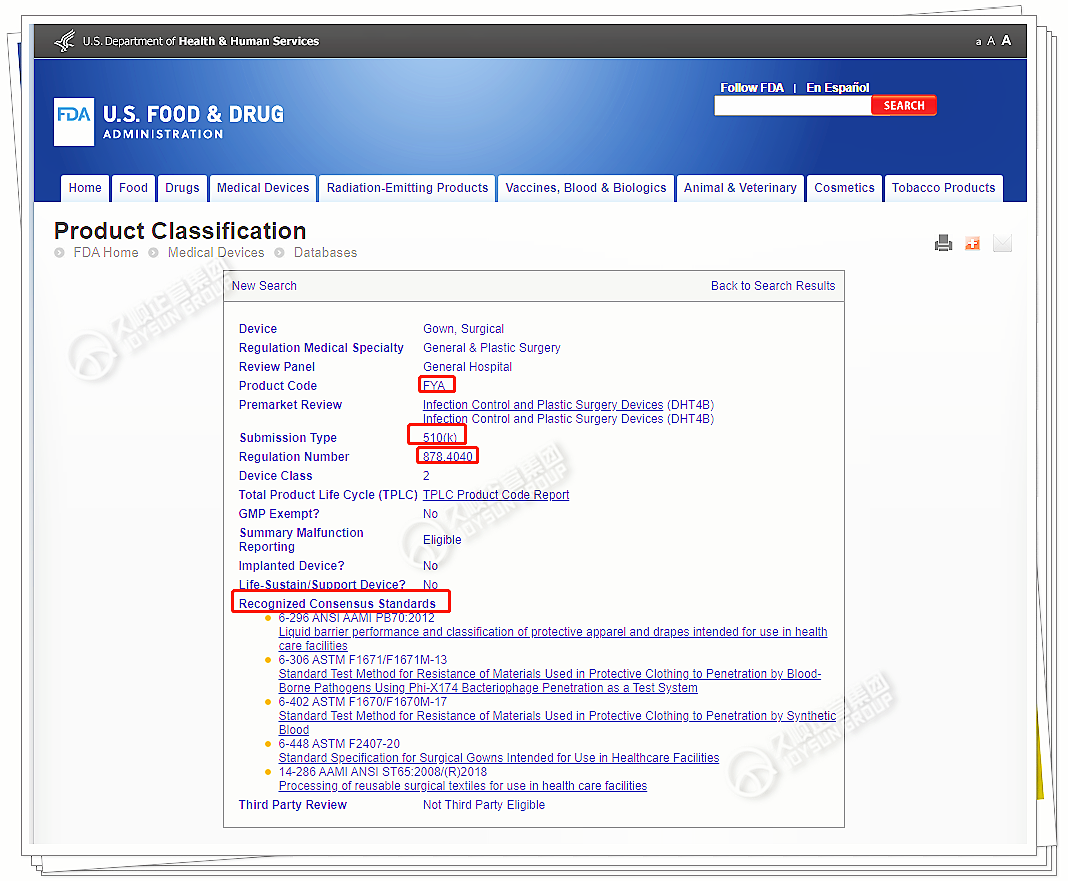
点开任意产品代码,界面展示信息,关键内容有:
1. 产品代码FYA
2. 提交类型(上市路径):510(K)
3. 产品分类等级:2类
4. 产品性能检测的相关标准
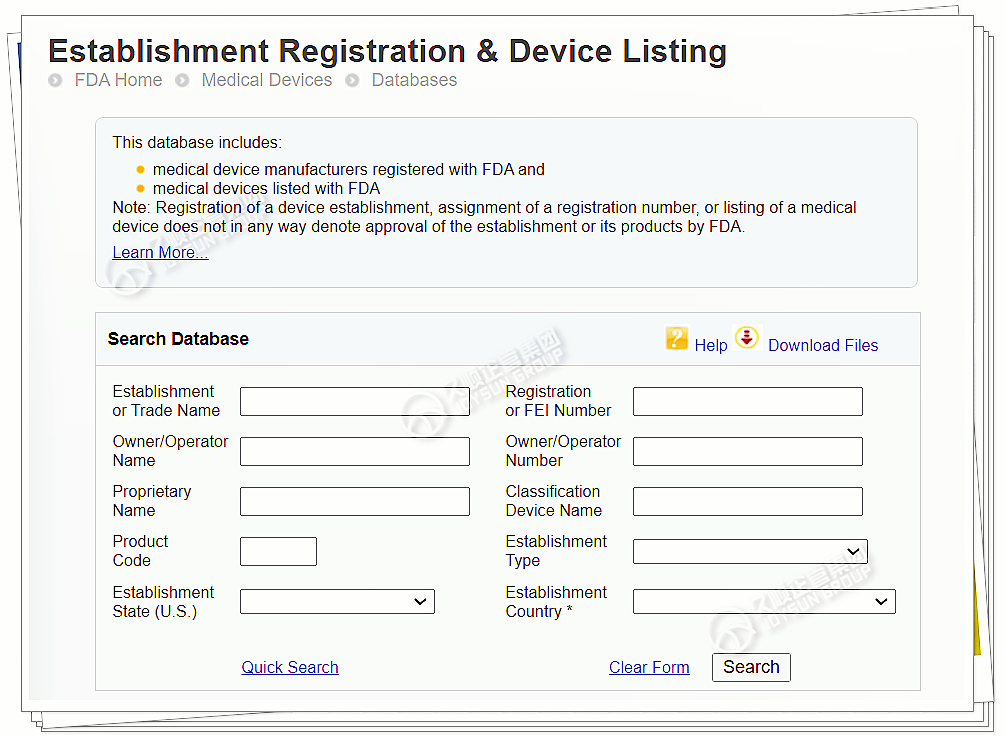
注册信息数据库的查询
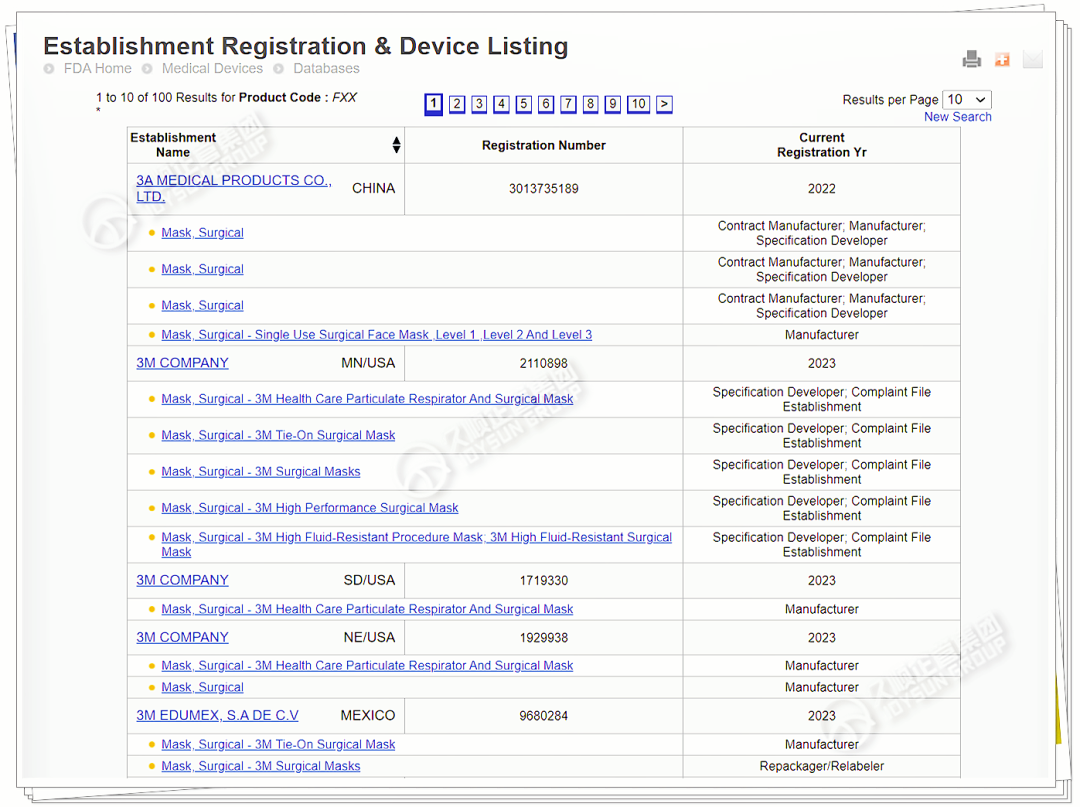
在医疗器械产品注册信息数据库,可查询产品名、已完成FDA企业列名和产品列名的信息,便于企业寻找合适等同产品、查询企业自身注册信息状态。
久顺的重要提示
按照FDA规定,每年10月1日至12月31日为下一年度再注册的时限,若在12月31日前未能按期注册,则次年FDA注册和认证将失效,产品无法在美国市场继续流通(详情可点击右侧回看往期推文>余额不足提醒: 你的FDA注册将失效[内附攻略])。
医疗器械出口美国,绝非一锤子买卖!需持续性维护!
得益于中国医疗器械制造企业技术水平、质量管理意识的提升,越来越多的制造商获得510K上市前通知、PMA上市前批准。
伴随日渐增多的出口产品而来,相关投诉、上市后监督等问题也接踵而来。
→ 此时,全程周到、可信可靠的合规技术服务显得尤为重要!
√ 久顺是您明智之选!近30年合规专家、资深美代,配备能力&资历俱佳的技术团队,成员超80%本科、硕士、博士比例,具备海外留学经验,无障碍英语口语书面交流,一站式快捷高效的FDA合规服务:法规符合性咨询及培训、证书获取、验厂等。具体服务项目如下:
1. FDA网站账户年度注册\产品列名,维持账户活跃;
2. 上市前批准510(K)、Pre-submission、De Novo分类请求的文件编制、递交及进度跟踪;
3. 邓白氏码查询、激活获取;
4. 产品分类、产品代码、等同产品的查询配对;
5. 申请创建UDI-DI、GUDID账户,GUDID数据库录入产品关键信息;
6. QSR820体系建立维护、FDA验厂咨询等...








 沪公网安备 31011502005499
沪公网安备 31011502005499