幽门螺杆菌理应引起重视
幽门螺杆菌Helicobacter pylori,简称Hp。2021年,美国公共卫生机构将Hp列为新增致癌物,进一步引起我国公众对Hp感染的重视。据《HP感染率与不同环境因素相关性的调查研究》报道,幽门螺杆菌(Hp)是人类最常见的慢性细菌感染,在全球自然细菌感染中超过50%。发展中国家感染率超过发达国家,越是经济落后、文化水平落后的地区感染率越高。
幽门螺杆菌之所以成为焦点,除感染率高之外,是其致癌性。据《柳叶刀》一项基于国内人群的研究中,非贲门胃癌的幽门螺杆菌感染率高达94.4%,贲门胃癌的感染率为92.2%。研究还指出我国至少有一半的胃癌发病都可以归咎于幽门螺杆菌感染。
幽门螺杆菌诊断的当前技术水平
幽门螺杆菌感染的诊断方法依据取材有无创伤性分为两大类:侵入性检测方法和非侵入性检测方法。
前者是指依赖胃镜取材的检测方法,包括组织学检测(如HE染色、Warthin-Starry银染、改良Giemsa染色、甲苯胺蓝染色、丫啶橙染色、免疫组织化学染色等)、细菌培养、快速尿素酶试验(RUT)、幽门螺杆菌核酸检测。
后者则包括血清学(抗体)检测、粪便幽门螺杆菌抗原检测或基因检测、尿素呼气试验(UBT)等,不同诊断方法有各自优势和局限性。
最新的国际、国内专家共识是:幽门螺杆菌现症感染的诊断,在临床应用的非侵入性幽门螺杆菌检测试验中,最为推荐的是尿素呼气试验(UBT)方法,单克隆抗体粪便抗原检测可作为备选。
血清学抗体检测阳性提示曾经感染,对于从未治疗者可视为现症感染;如受试者有内镜检查指征而无活检禁忌,且胃镜检查需要活检时,推荐RUT试验;对于胃炎活检标本,组织学染色阳性即可诊断幽门螺杆菌感染,阴性者可行免疫组化染色;如需进行幽门螺杆菌药物敏感性评价,可采用细菌培养结合药敏试验的方法或采用分子生物学方法检测相关耐药基因。
由于侵入法检测需要专业的医护人员进行取样检测,而非侵入性的尿素呼气试验也需要专业的医护人员进行操作,不适宜由患者自行检测。因此,粪便抗原检测成为患者自测的首选检测方法。
国内对幽门螺杆菌抗原产品的监管要求
幽门螺杆菌抗原产品在国内6840分类中属于III类,编号024。
从国家药监局医疗器械试剂数据中,以关键词“幽门螺杆菌抗原、幽门螺杆菌抗原、幽门螺杆菌(HP)抗原、幽门螺杆菌(HP)抗原”进行搜索,共有21个注册人持有21张幽门螺杆菌抗原检测证书。
其中检测方法学,主要有胶体金免疫层析法和乳胶法两种,均为依据NC膜为载体的固相层析方法,差异在于显色的物质。
诺辉健康宣布旗下幽门螺杆菌检测产品幽幽管获得国家药品监督管理局(NMPA)批准的三类医疗器械注册申请,成功获得国内幽门螺杆菌消费者自测产品第一证,也开启了国内幽门螺杆菌检测的居家自测时代!幽幽管属于抗原检测产品,注册产品名为幽门螺杆菌抗原检测试剂(乳胶法),采用久经验证的双抗体夹心法,检测粪便样本中是否存在幽门螺杆菌抗原。
欧盟、美国对幽门螺杆菌抗原产品的监管要求
幽门螺杆菌抗原产品在FDA数据库使用的Product code为LYR和OWF,属于510K路径。
搜索FDA数据库后,共得到93个结果:
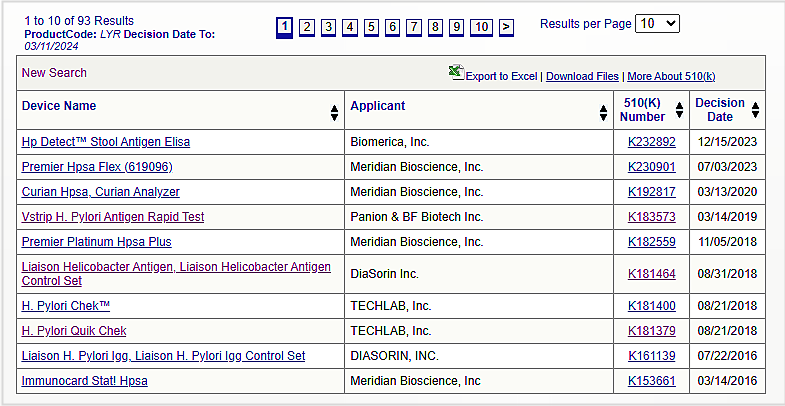
其中大部分产品是“Prescription Use处方使用”,而不是“Over-The-Counter Use非处方使用”。
专业用途幽门螺杆菌抗原产品根据其预期用途不同,在欧盟IVDR分类中可以分为以下2种情况:
Class C Rule 3h applies to devices with the specific intended purpose to be used in screening, diagnosis or staging of cancer.
A device intended for the quantitative/qualitative determination of IgG antibodies to Helicobacter pylori in human blood samples specifically intended to be used in gastric cancer screening.
Class B Rule 6 applies to devices not covered by rules 1-5.
Test to detect Helicobacter pylori, Clostridium difficile, adenovirus, rotavirus and Giardia lamblia.
自测用途幽门螺杆菌抗原产品,在欧盟IVDR分类中可以分为C类:Devices intended for self-testing are classified as class C.
#IVD自测产品畅销全球,合规准入是重要前提!选择靠谱的合规服务企业是关键!
→案例是最有力的代言! 久顺已成功辅导优思达生物获得TÜV南德签发的IVDR CE证书(涵盖10项产品),并助力其取得国内核酸检测领域首张IVDR荷兰CIBG注册证书。久顺为优思达提供了专业精湛的13485体系+IVDR辅导(CE技术文档辅导)、欧代 等关键性合规服务。
√作为国内少有的配备IVDR法规\技术\数据分析领域专业团队的企业,久顺已与欧盟各主流实验室和医院建立合作,提供临床性能研究(国内少有可胜任且使用EP文件研究)、可用性研究、上市后临床跟踪研究等高质高效服务。
√作为近30年全球合规技术专家、资深美代,久顺团队超80%本科、硕士、博士比例,具备海外留学经验,可无障碍英语口语和书面交流,可呈献一站式高效率FDA合规服务:法规符合性咨询及培训、证书获取、性能研究方案编写、临床性能方案制定、临床试验实施、FDA验厂 等。









 沪公网安备 31011502005499
沪公网安备 31011502005499