“医疗器械优先审批”和“创新医疗器械特别审批”同为国内医疗器械产品快速上市的通道,但两者在政策目标、适用条件、上市前优待、办理流程、结果影响等方面有着显著差异,本期带来两者区别的详细解读,以帮助制造商准确区分并应用这两种申请。
一、政策目标不同
1.创新医疗器械特别审查(“创新通道”):聚焦技术原创性/突破性,旨在保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展。
2.优先审批(“优先通道”):聚焦临床需求,旨在保障存在供应短缺或具有明显临床优势的医疗器械的临床使用需求。
二、适用条件不同

三、上市前优待项目的不同
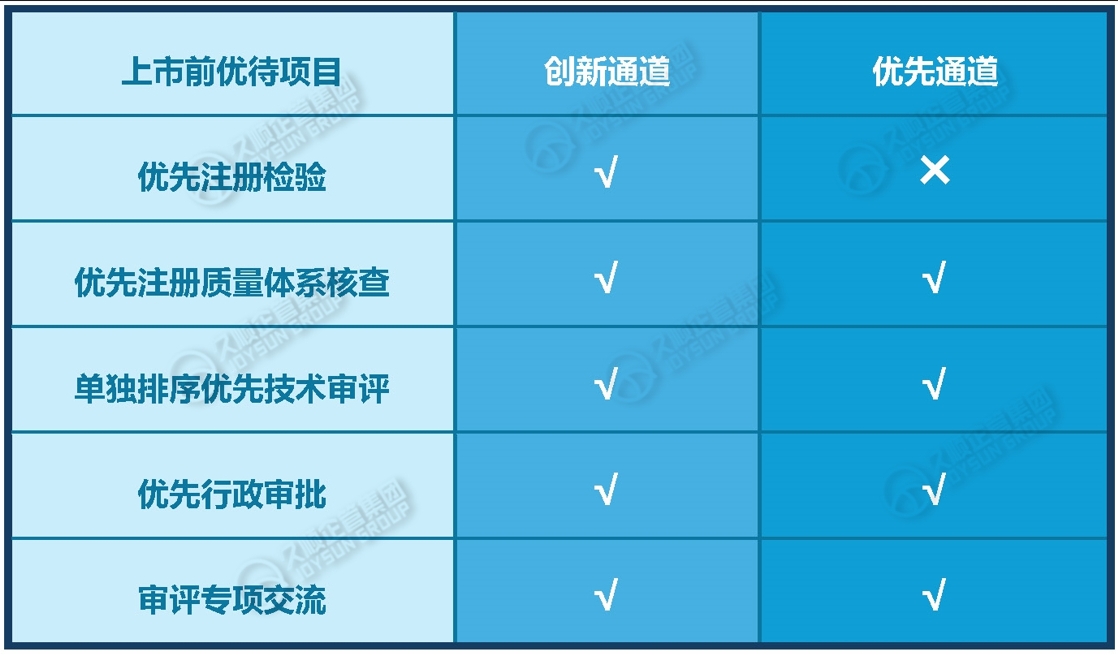
四、办理流程的不同
1.创新通道:
·境内申请人:向省级药品监督管理部门提出创新医疗器械特别审查申请。
省级药品监督管理部门初审(20个工作日),若不符合则会告知申请人,若符合则将申报资料和初审意见报送国家药品监督管理局医疗器械技术审评中心。
·境外申请人:向国家药品监督管理局提出创新医疗器械特别审查申请。
·由医疗器械技术审评中心进行形式审查(5个工作日内予以受理)。
·国家药品监督管理局医疗器械技术审评中心设立创新医疗器械审查办公室,组织专家进行审查(60个工作日)。
·公示申请人、产品名称(10个工作日)。
2.优先通道:
·向国家食品药品监督管理总局提出优先审批申请;
·由国家食品药品监督管理总局医疗器械注册申请受理部门进行形式审查;
·对优先审批申请材料齐全的且予以受理的注册申请项目,注明优先审批申请并转交技术审评中心;
·器审中心每月集中组织专家论证审核,出具审核意见。经专家论证需要优先审批的,拟定予以优先审批(对列入国家科技重大专项或国家重点研发计划的医疗器械,器审中心自收到申请之日起5个工作日内进行审核,符合优先审批情形的,拟定予以优先审批);
·网站公示申请人、产品名称、受理号(5个工作日)。
五、结果影响的不同
·创新通道:获得更早的技术指导,降低研发风险。
·优先通道:缩短注册审评时间。
六、制造商选择建议
·创新通道更适合:技术突破性强、研发风险高的项目,需早期与药监部门沟通优化方案。
案例--首个国产人工心脏(2019年通过创新通道获批)。
·优先通道更适合:临床需求明确、数据成熟的产品,需快速上市以抢占市场。
案例--新冠检测试剂(2020年通过优先通道紧急获批)。








 沪公网安备 31011502005499
沪公网安备 31011502005499