医疗器械软件,是单独或组合用于医疗器械法规或体外诊断医疗器械法规中“医疗器械”定义所规定用途的软件。
MDCG 2019-11《欧盟MDR和IVDR法规下软件的资格认定与分类指南》,旨在为制造商提供欧盟医疗器械软件(以下简称MDSW)鉴定及分类的指导,该指南于2025年6月迎来更新,以下是久顺对于主要变化的解读。
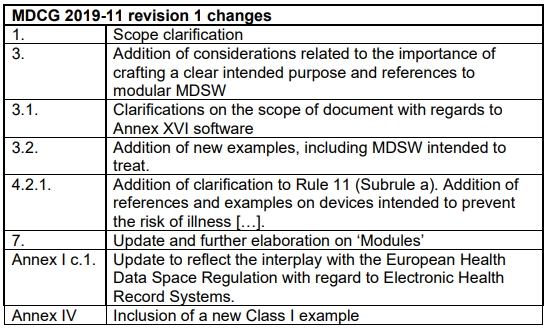
■ 范围澄清
新增:“医疗设备人工智能(MDAI)。
特别说明:在MDD中使用的“独立软件”术语,在MDR语境下已不再使用。该变化依据是软件应根据其特定预期用途进行资格认定和分类,而无需考虑其具体位置(例如:嵌入式,运行于特定平台、云端等)。
■ 新增“明确预期目的重要性的考虑因素“并提及”模块化 MDSW“
每个模块都必须单独符合监管标准,而且所有组件的集合功能应与所声明的预期用途保持一致。因此,制造商必须确保每个模块的预期用途获得明确的界定,并透明化说明及合理论证模块间的任何依存关系。
■ 澄清附录 XVI软件的文件范围
阐明软件仅用于非医疗目的(不包括MDR附录XVI中内容)如发票开具、员工考勤、邮件发送、网络或语音消息传递、数据解析等设备功能,文字处理、备份、健康或健身类应用程序等,不属于MDSW范畴。
■ 新增示例(包含MDSW所针对的病症)
1.对身体、饮食、形象等状况进行反馈、教育的软件
2.对阅读障碍的孩子有改善阅读作用的软件
3.分析身体参数或X光片等并提供康复计划的软件
4.缓解截肢者幻肢症状的VR软件
5.查看和分析如孕妇心电图MECG和胎儿心电图FECG设备的数据,为患者管理相关指标或分析的软件。
6.血压自我监测,MDSW控制硬件医疗设备、测量的收集、分析和解释数据。
7.通过虚拟现实暴露疗法VRET软件治疗创伤后应激障碍 PTSD患者
8.扩展软件,在CT、X光、超声、内窥镜、MRI等硬件基础上识别更多临床症状的软件
9.评估心理状态的软件
10.读取血糖仪试纸条,指导非专业人士使用胰岛素的软件
■ 补充说明规则11(子规则 a),增加旨在预防疾病风险的器械内容及示例
详细说明:提供用于诊断或治疗决策信息的软件被归类为IIa。例如:旨在通过分析生理参数(如脊椎后部的排列情况、动脉硬度的分析等)以预防疾病或病理风险的器械,可被视为提供信息的器械,这些信息用于作出诊断目的决策(潜在的病理检测),在此情况下该软件被归类为IIa。
■ 更新及进一步阐述“模块”内容
详细解释:并非所有模块都具有直接医疗用途(如患者记录管理、预约安排或通讯),但非医疗功能对于MDSW的医疗目的而言必不可少,在此情况下以下内容适用:
1.如果非医疗功能对于MDSW运行是必要的,则前述功能不应被排除于MDSW描述外;
2.制造商必须评估这些功能特性对设备整体安全性和性能的影响;
3.必须提供详尽的文档,用于说明医疗功能与非医疗功能之间的相互作用、如何共同实现整体医疗预期目标。
■ Annex I c.1更新内容,旨在反映与欧洲健康数据空间法规在电子健康记录系统方面的相互作用。
重新描述信息系统:仅用于传输、存储、转换、格式化、归档数据的信息系统,其本身并不属于医疗器械范畴,但其可以同附加模块配合使用,而前述附加模块本身可能被视为MDSW。
■ Annex IV新增一个I类示例
增加:旨在帮助沟通障碍者(如脑瘫、自闭症ASD、选择性默症、多发性硬化症、肌萎缩侧索硬化症、唐氏综合征、失语症等)进行交流,将一组选定的符号转换成口语形式,选择方式可根据患者病情采用多种形式实现,如触摸屏、头部追踪或眼动追踪。按照规则11c规定,此款MDSW应被归类为I类。








 沪公网安备 31011502005499
沪公网安备 31011502005499