本期以“一次性使用无菌尿液引流袋”为例,解读其国内注册审查要求。
1.监管信息
1.1命名规则:核心词“尿液引流袋”,特征词如“一次性使用无菌”“防返流”(如“一次性使用无菌防返流尿液引流袋”)。
1.2注册单元划分:
·同一单元:结构功能相似(如普通型不同容量)。
·不同单元:功能差异显著(如防返流型、精密测量型需单独申报)。
1.3型号规格:明确划分依据(如容量500mL、1000mL)。
2.综述资料
2.1工作原理:重力引流(贮尿袋需低于膀胱水平)。
2.2结构组成:列明所有组件材料(如PVC薄膜、止流阀材质)。
2.3不良事件:关注关闭阀失效、衔接不紧、渗漏等问题(参考MAUDE、MDA数据库)。
3.非临床资料
3.1风险管理:
·生物学风险:灭菌失效(SAL需达10⁻⁶)、包装破损污染。
·化学风险:环氧乙烷残留(EO≤10μg/g)、PVC增塑剂迁移。
·机械风险:袋体热合处泄漏、挂钩断裂、导管牵拉导致脱管。
3.2技术要求:
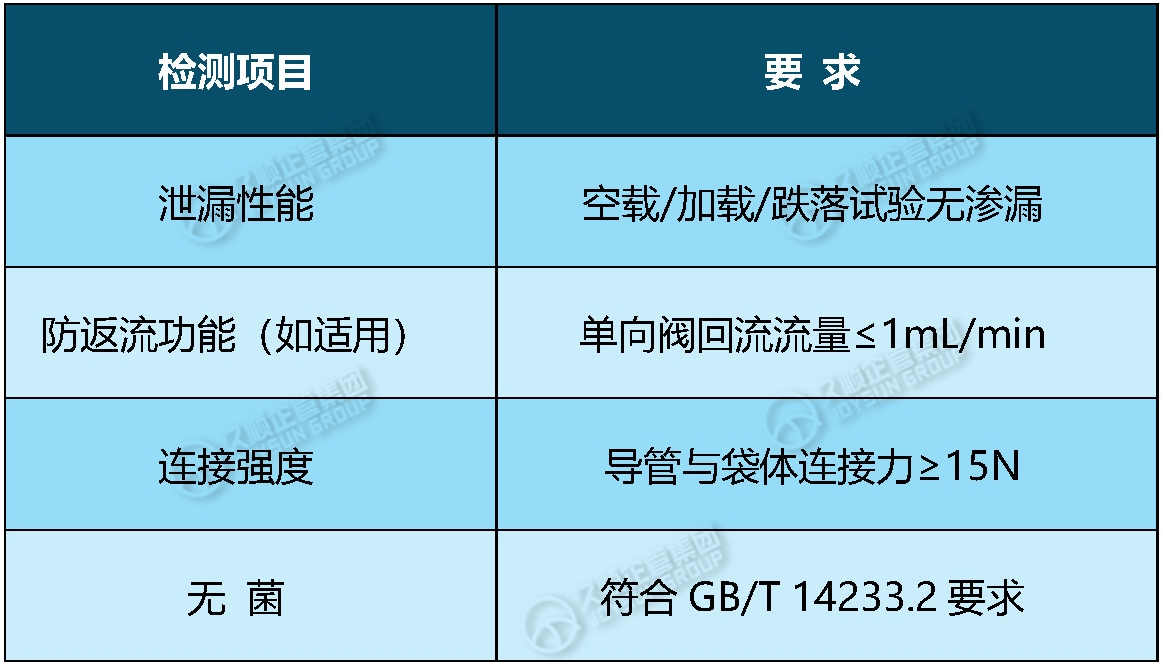
3.3研究资料:
·生物相容性:接触皮肤的腿部/腹部尿袋需进行细胞毒性、皮肤刺激、致敏试验。
·灭菌工艺:辐射灭菌(GB 18280系列)为优先,环氧乙烷灭菌需验证残留解析。
·有效期:实时老化验证(参考YY/T 0681.1),包装需通过运输测试(GB/T 4857)。
·特殊产品:儿童型需验证人体工学设计;防返流型需提交功能验证报告。
4.临床评价
该产品已被列入《免于临床评价目录》,需提交与同类产品的对比说明(结构、性能、适用范围)。
5.说明书与标签
5.1关键内容:
·灭菌方式、有效期、“一次性使用”警示。
·悬挂高度要求(低于膀胱水平)。
·最长更换时间(如24小时)及依据。
·儿童型需标注适用年龄。
5.2标签标识:初包装应标UDI、批号、失效日期。
6.质量管理体系
6.1生产工艺:明确热合、灭菌等关键工序控制点。
6.2原材料控制:PVC等材料需符合GB/T 15593,出具供应商资质及质检报告。
*【久顺企管集团】近30年全球合规技术专家,中国\西班牙\荷兰\美国\英国均设公司,擅长产品注册、临床研究与临床评价、生产许可证、经营许可证、质量体系GMP等服务,优厚的咨询管理和技术服务经验,深耕无菌\非无菌\植入\有源\体外诊断等医疗器械领域,为产品畅行全球护航。








 沪公网安备 31011502005499
沪公网安备 31011502005499