2025年12月16日,欧盟委员会正式提出修订提案,旨在对医疗器械条例MDR和体外诊断医疗器械条例IVDR进行重大调整。此次改革的核心目标是简化监管框架、减轻企业负担、提升认证效率与可预测性,同时确保不降低对患者安全和公共健康的高水平保护。此举标志着欧盟医疗器械监管将进入一个更加灵活、高效的新阶段。
自MDR和IVDR分别于2021年和2022年生效以来,其更严格的临床证据要求、更复杂的符合性评估程序以及指定公告机构数量不足等问题逐渐暴露。尽管过渡期已多次延长,但这并未解决结构性矛盾:
·企业成本高企:尤其对占行业90%的中小企业SME,合规成本被认为与其实际风险“不成比例”。
·设备可及性风险:严苛要求可能导致关键、创新或小众设备退出市场,影响患者护理。
·市场竞争力受损:复杂的流程和不确定的时间线削弱了欧盟医疗器械产业的创新活力与国际竞争力。
一项针对性评估最终得出结论:当前框架存在“过度复杂、负担沉重、效率低下”的短板,亟需优化。
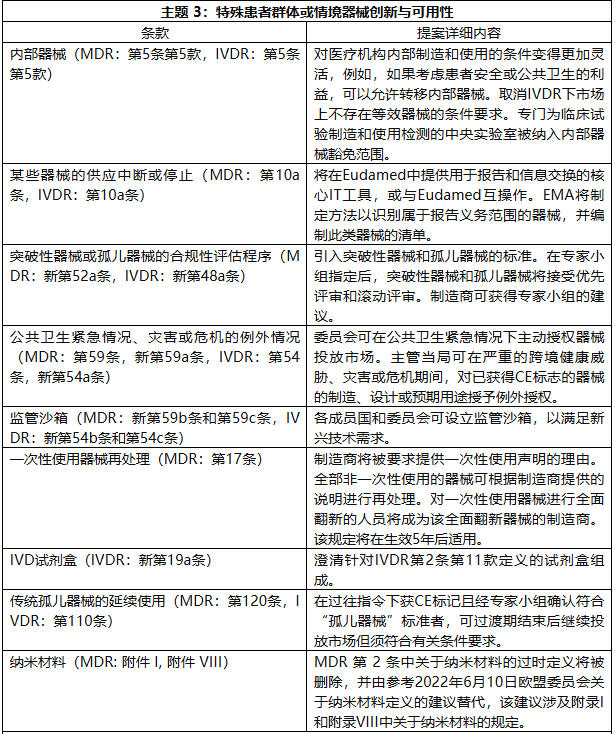
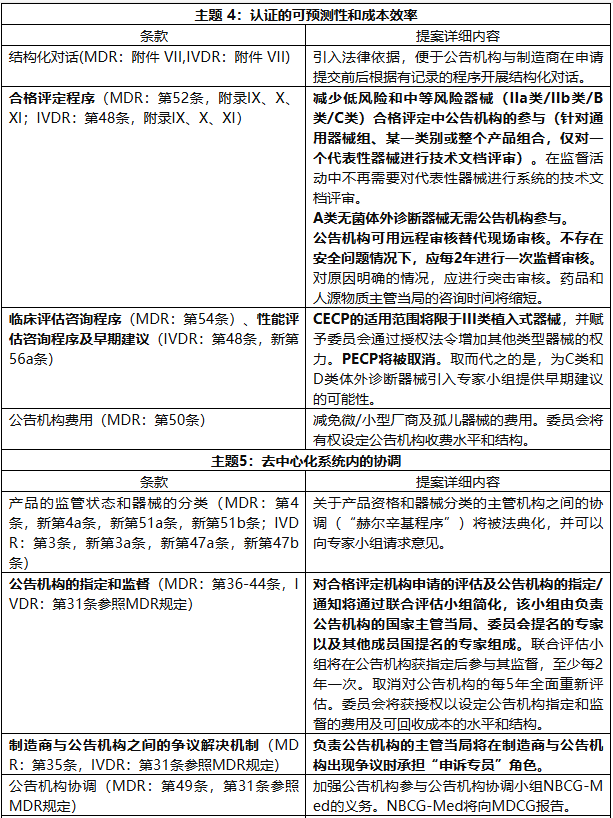
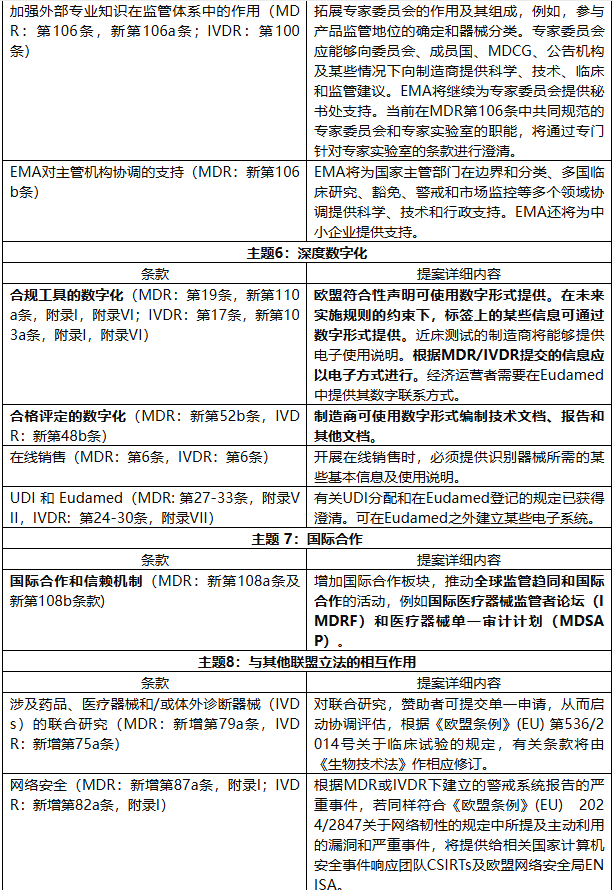
提案围绕八大主题展开,旨在构建一个更精简、更成比例、更具韧性的监管体系。
该修正案根据主题及对应法规条款、提案详细内容,对MDR和IVDR法规修订如下:

·观点总结
欧盟此次法规修订提案是一次重要的“纠偏”与“优化”,力图在坚守安全底线与激发产业活力之间找到新的平衡点。其回应了业界长期的呼声,也反映了欧盟提升其医疗技术领域全球竞争力的决心。未来几年,随着新规的逐步落地,欧洲医疗器械市场有望迎来监管更智能、创新更便捷、准入更高效的新时代。
对于广大医疗器械制造商,特别是计划进入或深耕欧洲市场的中国企业而言,密切关注此提案的立法进程并提前理解其变化内涵,将是把握未来市场机遇的关键一步,久顺将为您作持续跟进与报道。
√ 欧盟MDR/IVDR CE申请,久顺值得您信赖!
→欢迎联系【久顺企管集团】始创于1996年,西班牙、荷兰、英国、美国、中国均设公司,近30年全球合规技术专家,全程高效的欧盟合规服务:√CE注册取证 √技术文档编写 √合规策略 √体系辅导 √上市后监督咨询 √近20年资深欧代 √临床方案设计\临床试验方案编撰 √收集\整理\分析试验原始数据并出具临床试验报告等。








 沪公网安备 31011502005499
沪公网安备 31011502005499