国家药监局发布:这些医疗器械免临床评价!
为做好医疗器械注册管理工作,根据《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号),国家药监局组织修订了《免于进行临床评价医疗器械目录(2023年)》(国家药监局通告2023年第33号),形成《免于进行临床评价医疗器械目录(2025年)》,现予公布,并自公布之日起施行。
高端医械迎发展利好!国家药监局公布"10项重磅措施"
6月20日,国家药监局党组书记、局长李利主持召开会议,研究部署支持高端医疗器械创新发展举措,审议通过《关于优化全生命周期监管支持高端医疗器械创新发展的举措》(以下简称《举措》)。
√《举措》包括 十方面具体措施 :
1. 优化特殊审批程序
2. 完善分类和命名原则
3. 持续健全标准体系
4. 进一步明晰注册审查要求
5. 健全沟通指导机制和专家咨询机制
6. 细化上市后监管要求
7. 强化上市后质量安全监测
8. 密切跟进产业发展
9. 推进监管科学研究
10. 推动全球监管协调
国家药监局全新发布:这些IVD免临床试验(含部分三类)!
根据《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号),国家药监局组织修订了《免于进行临床试验体外诊断试剂目录》(国家药监局通告2021年第70号),形成《免于进行临床试验体外诊断试剂目录(2025年)》,现予公布,并自公布之日起施行。
IVD厂商利好:中马监管互认试点,明确申请资质及提交要求
马来西亚医疗器械管理局MDA发布公告《马来西亚-中国医疗器械监管互认计划的实施(试点第一阶段:2025 年7月30日至9月30日)》。
UDI豁免名单及实施时间出炉!
为进一步贯彻落实《医疗器械监督管理条例》《国务院办公厅关于全面深化药品医疗器械监管改革 促进医药产业高质量发展的意见》和国务院深化医药卫生体制改革有关重点工作任务,推进医疗器械唯一标识在 监管、医疗、医保等领域的衔接应用,国家药监局组织起草了《关于特定情形实施医疗器械唯一标识有关事项的公告(征求意见稿)》、《关于做好后续品种实施医疗器械唯一标识工作的公告(征求意见稿)》。
警钟长鸣:国家药监局发布1-3号医疗器械飞检通告
《医疗器械飞行检查情况通告(2025年第1-3号)》
国家药监局发布多项医疗器械注册指导原则(含征求意见稿)
· 体外诊断试剂稳定性研究注册审查指导原则
·ALDH2基因多态性检测试剂注册审查指导原则
·人MTHFR基因多态性检测试剂注册审查指导原则
·雌激素受体、孕激素受体抗体试剂及检测试剂盒注册审查指导原则(2025年修订版)
·全自动化学发光免疫分析仪注册审查指导原则(2025年修订版)
·乙型肝炎病毒基因分型检测试剂注册审查指导原则(2025年修订版)
·丙型肝炎病毒核糖核酸检测试剂注册审查指导原则(2025年修订版)
·癌症筛查体外诊断试剂临床评价注册审查指导原则
·结直肠癌筛查体外诊断试剂临床评价注册审查指导原则
·高危型人乳头瘤病毒(HPV)核酸检测及基因分型试剂注册审查指导原则(2025年修订稿)
·人类嗜T淋巴细胞病毒抗体检测试剂注册审查指导原则
·光固化氢氧化钙盖髓剂产品注册审查指导原则(征求意见稿)
·牙科纤维桩产品注册审查指导原则(2025年修订)(征求意见稿)
·颅颌面内固定系统注册审查指导原则(征求意见稿)
·钙磷/硅类骨填充材料注册审查指导原则(2025年修订)(征求意见稿)
·髋关节假体系统注册审查指导原则(2025年修订)(征求意见稿)
·肘关节假体系统注册审查指导原则(征求意见稿)
·人工颈椎间盘假体注册审查指导原则(2025年修订)(征求意见稿)
·电动牵引装置注册审查指导原则(2025年修订版)
·紫外治疗设备注册审查指导原则(2025年修订版)
·红外线治疗设备注册审查指导原则(2025年修订版)
·中频电疗产品注册技术审查指导原则(2025年修订版)
·一次性使用心电电极注册审查指导原则(2025年修订版)
·心电图机产品注册审查指导原则(2025年修订版)
·病人监护产品(第二类)注册审查指导原则(2025年修订版)
·医用电动吸引器注册审查指导原则(2025年修订版)
·酶联免疫分析仪注册审查指导原则(2025年修订版)
·第二类腹腔镜手术器械产品注册审查指导原则(2025年修订版)
·硬性光学内窥镜(自然孔道类)注册审查指导原则(2025年修订版)
·视野计注册审查指导原则(2025年修订版)
·可见光谱治疗仪注册审查指导原则(2025修订版)
·裂隙灯显微镜注册审查指导原则(2025年修订版)
·动态血压测量仪注册审查指导原则(2025年修订版)
·动态心电图机注册审查指导原则(2025修订版)
·手术无影灯注册审查指导原则(2025年修订版)
·红外乳腺检查仪注册审查指导原则(2025年修订版)
·电动轮椅车注册审查指导原则(2025年修订版)
·红外耳温计注册审查指导原则(2025年修订版)
·小型压力蒸汽灭菌器注册审查指导原则(2025年修订版)
·输液泵注册审查指导原则(2025年修订版)
·中央监护软件注册审查指导原则(2025年修订版)
·半导体激光治疗设备(第二类)注册审查指导原则(2025年修订版)
·超声多普勒胎儿监护仪注册审查指导原则(2025年修订版)
·超声理疗设备注册审查指导原则(2025年修订版)
·超声多普勒胎儿心率仪注册审查指导原则(2025年修订版)
·超声洁牙设备注册审查指导原则(2025年修订版)
·血管内球囊扩张导管用球囊充压装置注册审查指导原则(2025年修订版)
·子宫输卵管造影球囊导管注册审查指导原则(2025年修订版)
·验光仪注册审查指导原则(2025年修订版)
·软性纤维内窥镜注册审查指导原则(2025年修订版)
·医用臭氧妇科治疗仪注册审查指导原则(2025年修订版)
·超声骨密度仪注册审查指导原则(2025年修订版)
·高密度脂蛋白胆固醇测定试剂注册审查指导原则(2025年修订版)
·促黄体生成素检测试剂(胶体金免疫层析法)注册审查指导原则(2025年修订版)
·心肌肌钙蛋白I/肌红蛋白/肌酸激酶同工酶MB检测试剂(胶体金免疫层析法)注册审查指导原则(2025年修订版)
·电解质钾、钠、氯、钙测定试剂注册审查指导原则(2025年修订版)
·胱抑素C测定试剂注册审查指导原则(2025年修订版)
· 麻醉储气囊产品注册审查指导原则(征求意见稿)
·一次性无菌眼科无源手术器械指导原则(2025年修订版)(征求意见稿)
·内窥镜刮匙注册审查指导原则(征求意见稿)
·定制式正畸矫治器注册审查指导原则(征求意见稿)
·牙科种植用导板注册审查指导原则(征求意见稿)
·临时冠桥注册审查指导原则(征求意见稿)
·全瓷义齿用玻璃陶瓷瓷块产品注册审查指导原则(征求意见稿)
·手术用剥离器产品注册审查指导原则(征求意见稿)
·止血绷带注册审查指导原则(征求意见稿)
·新生儿吸氧头罩注册审查指导原则(征求意见稿)
·一次性使用脐带剪注册审查指导原则(征求意见稿)
·N-乙酰-β-D-氨基葡萄糖苷酶检测试剂注册审查指导原则(征求意见稿)
·医用敷料同品种临床评价注册审查指导原则(征求意见稿)
·骨科外固定支架注册审查指导原则(2025年修订版)(征求意见稿)
·全瓷义齿用氧化锆瓷块注册审查指导原则(2025年修订版)(征求意见稿)
·定制式义齿注册审查指导原则(2025年修订版)(征求意见稿)
·骨水泥套管组件注册审查指导原则(2025修订版)(征求意见稿)
·一次性使用医用喉罩注册审查指导原则(2025年修订版)(征求意见稿)
·外科纱布敷料注册审查指导原则(2025年修订版)(征求意见稿)
·吻(缝)合器注册审查指导原则(2025年修订版)(征求意见稿)
·一次性使用吸痰管产品注册审查指导原则(2025年修订版)(征求意见稿)
·护脐带注册审查指导原则(2025年修订版)(征求意见稿)
·鼻饲营养导管注册审查指导原则(2025年修订版)(征求意见稿)
·一次性使用无菌导尿管注册技术审查指导原则(2025年修订版)(征求意见稿)
·微创青光眼手术植入用青光眼引流装置注册审查指导原则(征求意见稿)
·中心静脉导管注册审查指导原则(2025年修订版)(征求意见稿)
国家药监局发布多项医疗器械标准
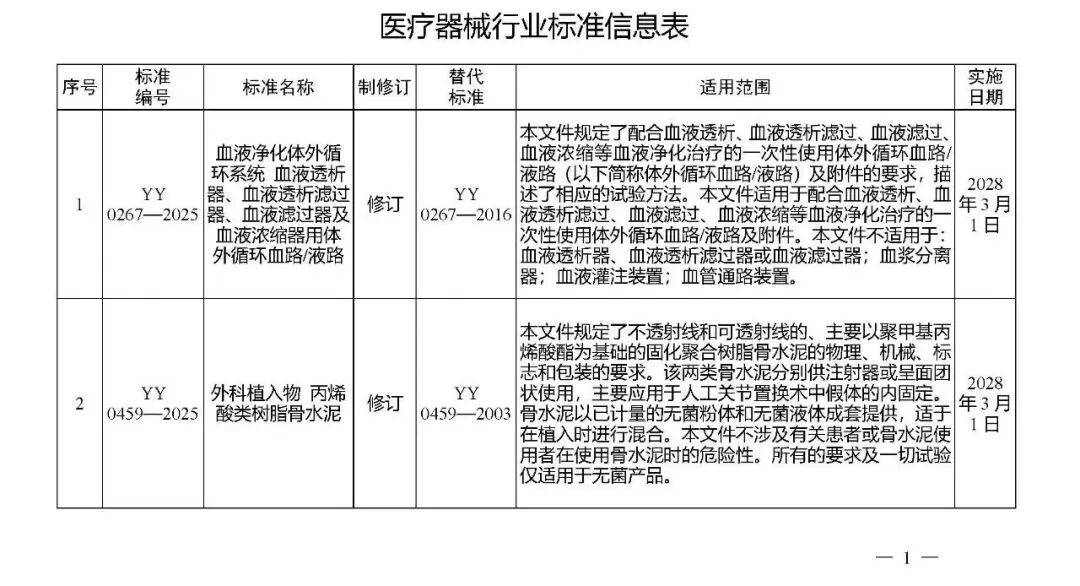
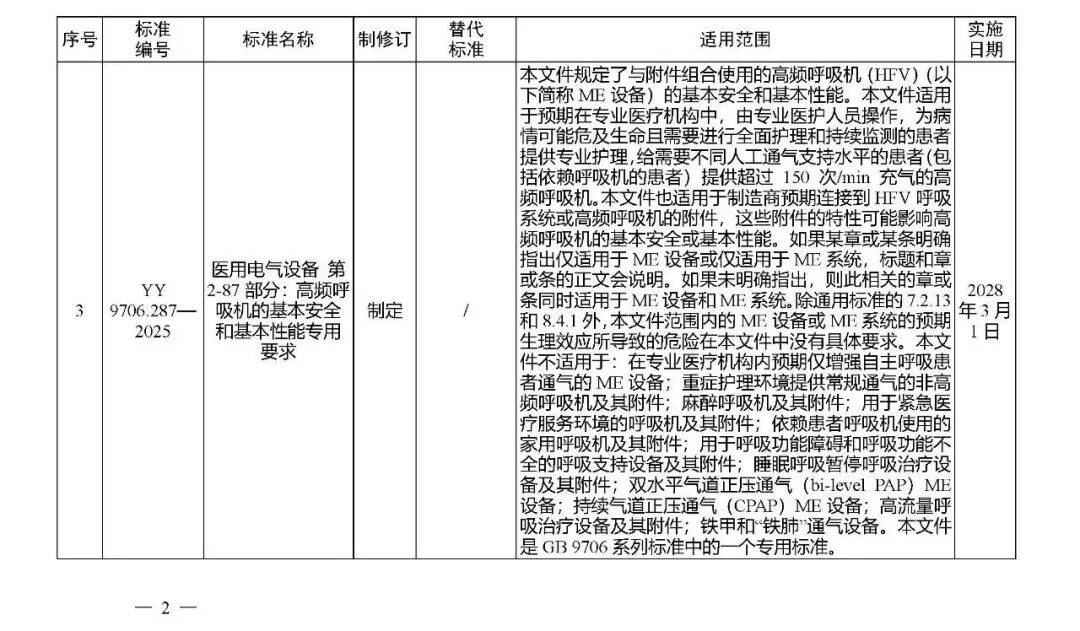
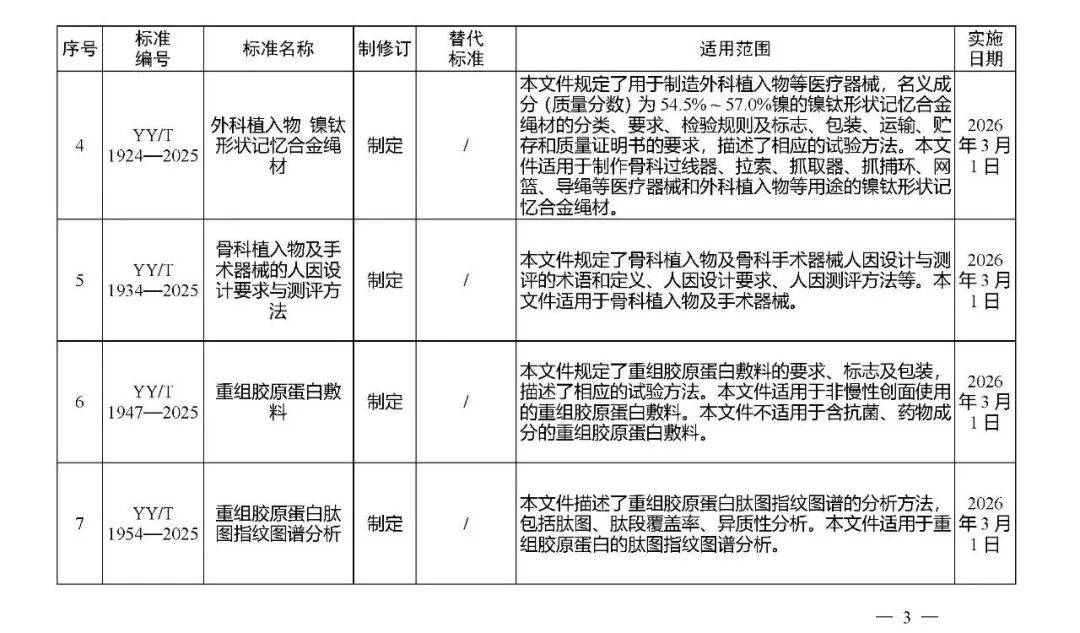
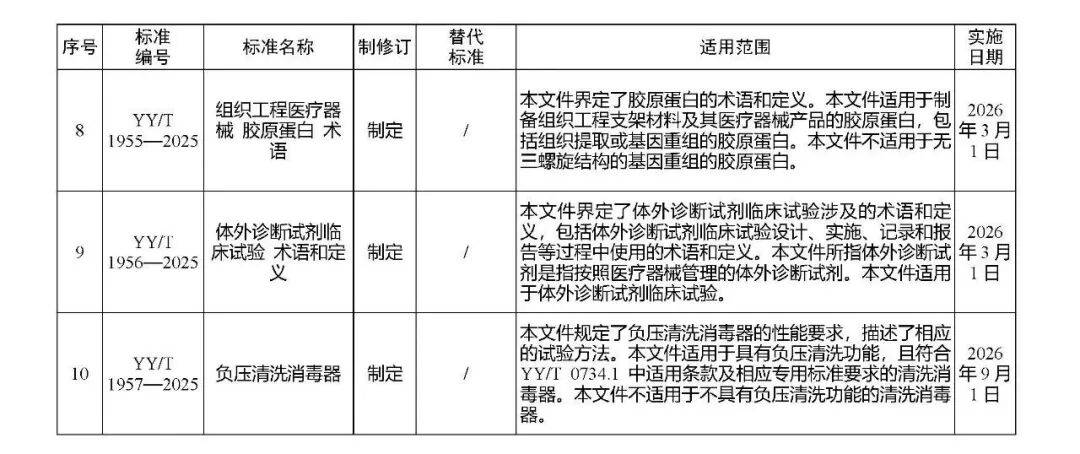

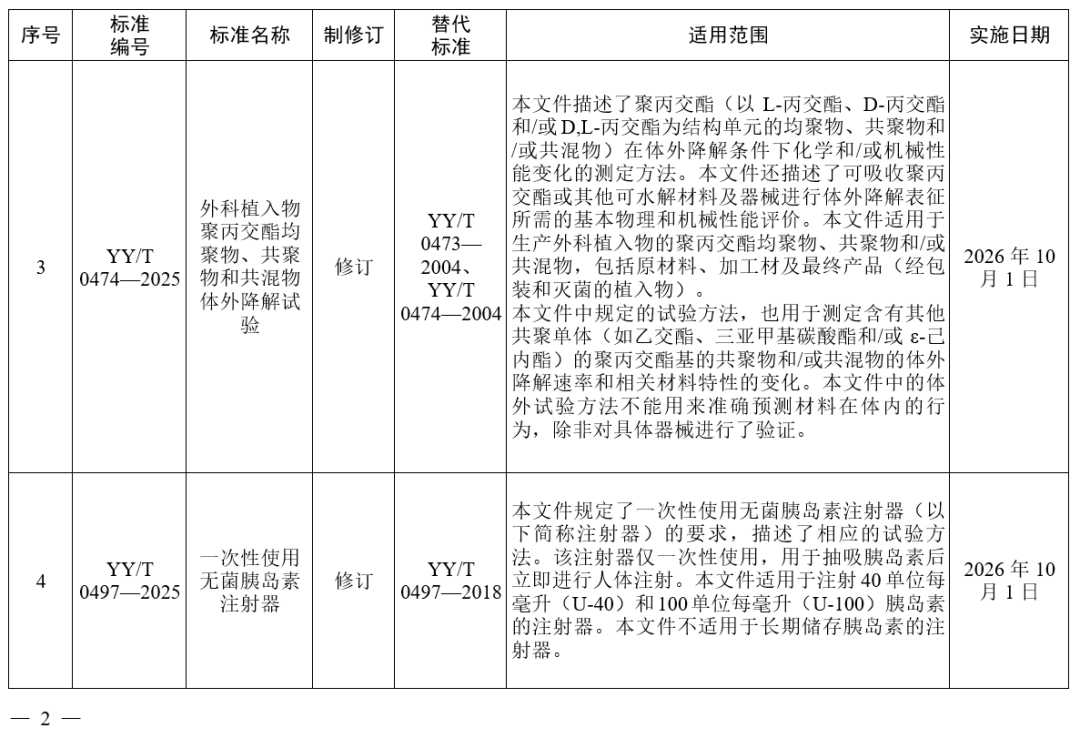
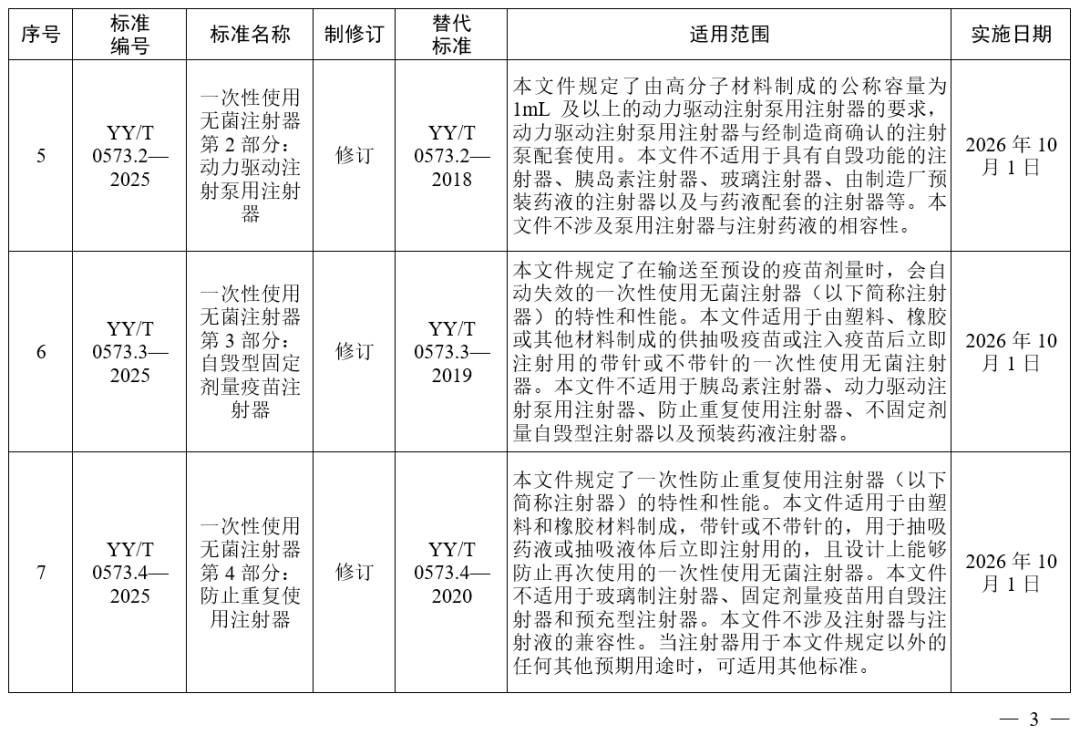

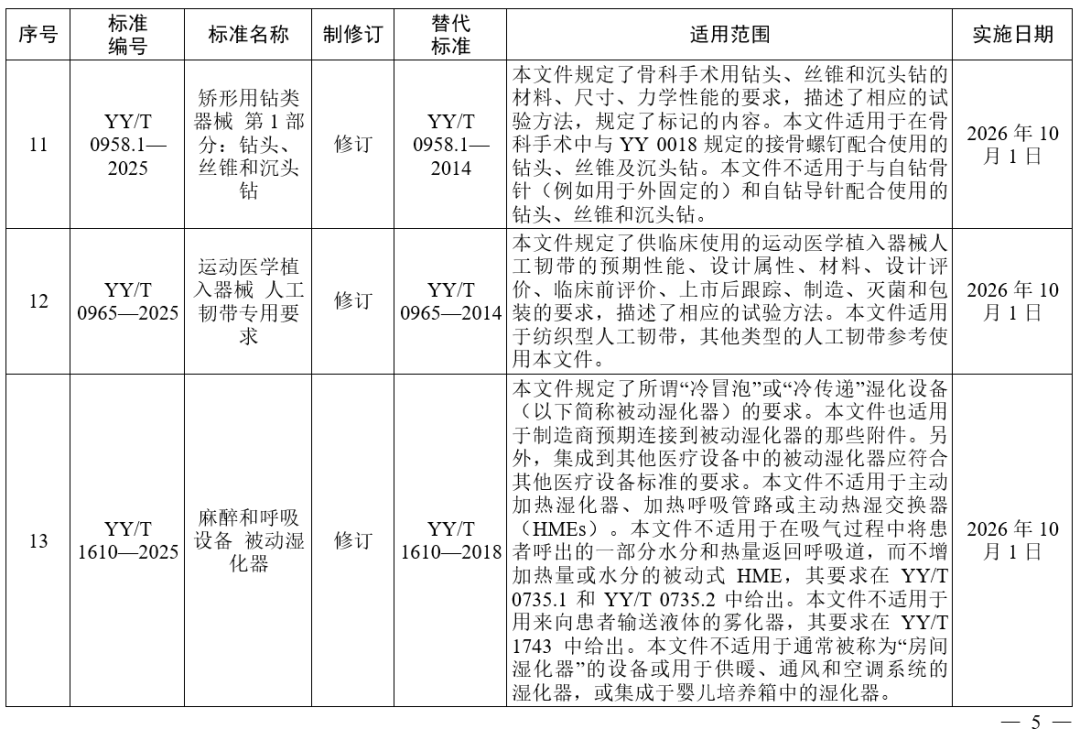
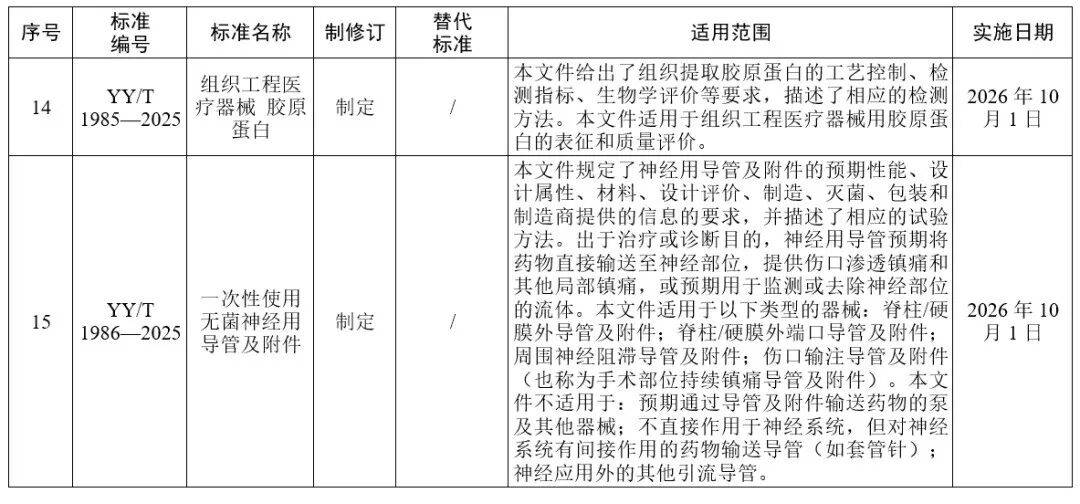

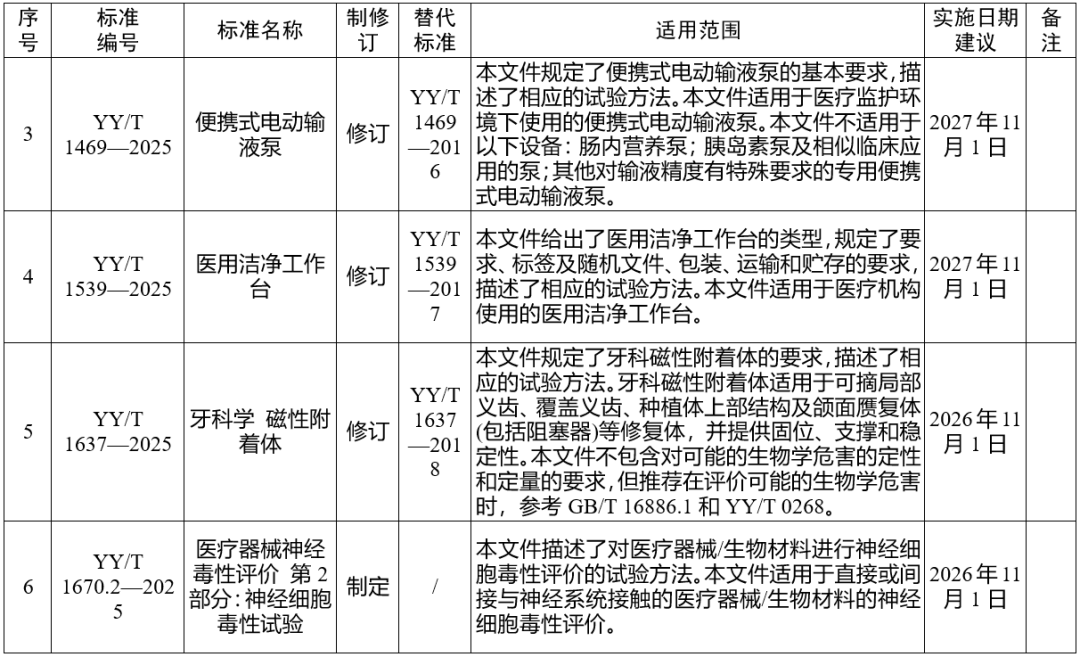

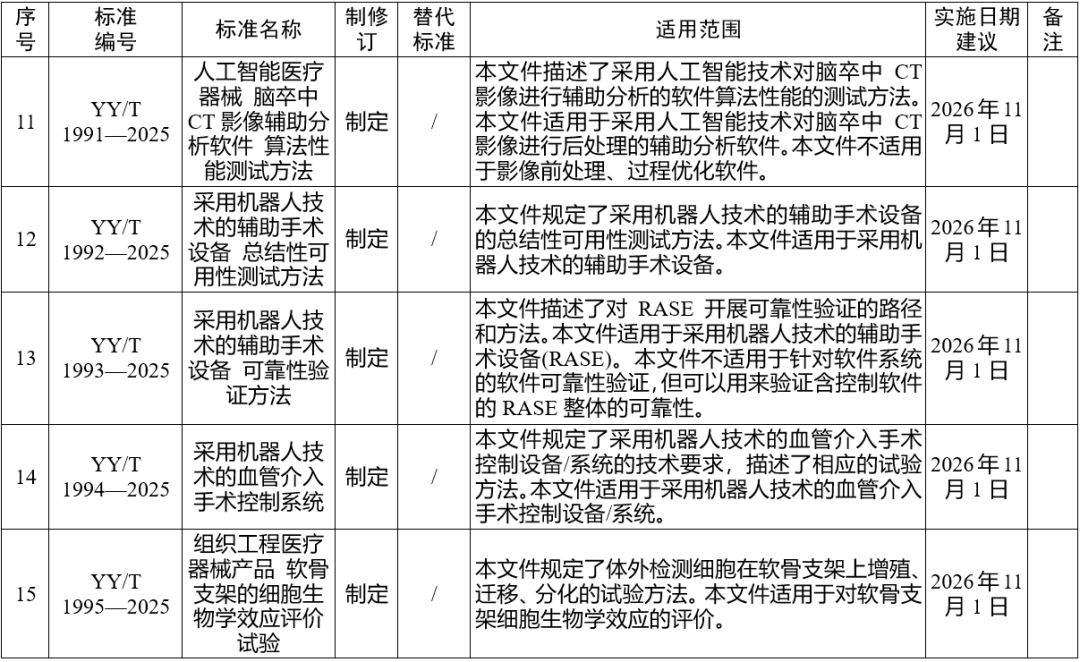
·体外诊断医疗器械 多重核酸分子检测 第2部分:确认和验证(征求意见稿)
·体外诊断医疗器械 制造商提供的信息(标示)第2部分:专业用体外诊断试剂(征求意见稿)
·医学实验室 ISO 15189在临床病理学的应用指南(征求意见稿)
·临床化学体外诊断试剂盒(征求意见稿)
·促黄体生成素检测试剂盒(免疫层析法)(征求意见稿)
·体外诊断医疗器械 制造商提供的信息(标示)第1部分:术语、定义和通用要求(征求意见稿)
·体外诊断医疗器械 制造商提供的信息(标示) 第4部分:自测用体外诊断试剂(征求意见稿)
·体外诊断医疗器械 制造商提供的信息(标示)第3部分:专业用体外诊断仪器(征求意见稿)
·体外诊断医疗器械 制造商提供的信息(标示) 第5部分:自测用体外诊断仪器(征求意见稿)
·临床实验室检验和体外医疗器械 口服抗凝治疗自测体外监测系统的要求(征求意见稿)
·医学实验室 检验样品采集和运送的要求(征求意见稿)
【来源:国家药监局】
# 国内注册要快&还要好?认准久顺就对了!
>>【久顺企管集团】医械注册的加速引擎! 30年全球合规技术专家,中国\荷兰\西班牙\美国\英国均设公司,擅长注册全程辅导、技术文档编写、质量体系建立完善及咨询等服务,以及CE/FDA/UKCA/CFS等证书办理,具备优厚的咨询管理和技术服务经验及能力,护航产品全球范围高速畅行。








 沪公网安备 31011502005499
沪公网安备 31011502005499