由 CCBio、久顺企管集团 主办的《医疗器械注册专题系列讲座》--NMPA注册法规要求及申报注意事项专题讲座今天在上海自贸壹号生命科技产业园圆满举办。本次会议也是CCBio医疗器械合规系列的第四场。
2017-2018年堪称为中国医疗器械法规年。2年间,医疗器械法规更新数量与尺度,前所未有。在国家多重政策的大力支持下,医疗器械产业正在日新月异的高速发展,医疗器械企业如雨后春笋一般。本次会议可谓雪中送炭。CCBio邀请了久顺企管集团宋福明专家团队讲师,从中国医疗器械法规体系、法规最新变化解读、医疗器械注册申报经验分享等多个方面,为医疗器械从业人士带来了一场医疗器械法规知识盛宴。
活动同时邀请了全国卫生产业企业管理协会医学检验产业分会、上海医疗器械行业协会、浦东新区科技企业孵化联盟和丁香园等合作伙伴协办本次活动。
上海自贸壹号生命科技园作为联合主办方,是一家医疗器械专业产业园区,为企业提供能满足医疗器械企业特殊要求的物理空间,同时自有的医疗器械创新技术转化中心提供专业的医疗器械CRO+CDMO第三方服务,在医疗器械注册人制度下,打造医疗器械从研发到上市的全生命周期服务。
本次专题讲座吸引了一百多位全国医疗器械企业的企业主及专家代表参会。

本次培训第一个议题:医疗器械注册法规监管体系 。
宋福明专家团队讲师,从四大方面:注册背景、注册法规分析、注册工作流程、技术审评要求等,系统分析中国医疗器械法规监管体系,及法规的最新变化。
中国医疗器械行业的监管,从国务院,到国家市场监督管理局,到国家药品监督管理局,再到省级药监局。原食品药品监督管理总局,刚刚更名为药品监督管理局,NMPA,全新官网也新鲜上线。
随着政府的机构改革,药监局的职能与定位,也做了大的调整。
年中送审,并正在征求意见中的《医疗器械监督管理条例 修正案》(草案送审稿),在680号令的基础上,提出多项重大改革,在行业内引起轩然大波。

从2017年开始试行的“上海医疗器械注册人制度”,到年中《条例修正案》送审稿中提及的“上市许可人制度”MAH;
从《医疗器械注册管理办法》(4号令),到《创新医疗器械特别审查程序》,以及技术审评补正资料预审查服务等;
Jason老师从国家管理思路上的政策导向,特别是对于市场的重要意义,以及尤其困扰广大企业的申报周期做了具体分享,与会者对此有了更好的感性认识。

“证照分离”改革,更是在年末掀起又一波国家政策改革高潮,带来重大市场利好。
其中,涉医疗器械的重头戏,当属多条“压缩审评时限,将法定审批时限压缩三分之一”,可谓引发无限期待。
随着医疗器械产业的快速发展,新技术、新产品的不断涌现,医疗器械分类体系已难以适应产业发展和监管工作的需要。Jason老师分别对8月1日正式生效的《医疗器械分类目录》,以及据此于9月30日发布生效的《免于进行临床试验医疗器械目录》、《免于进行临床试验的体外诊断试剂目录》做了精彩讲解,并做举例说明。
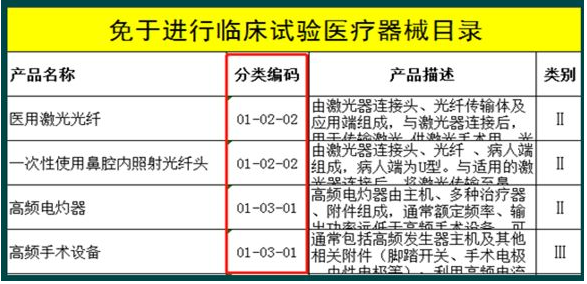
最后,Jason老师对注册申报清单做了提纲式分析,并特别强调了很多企业傻傻分不清的延续注册,产品不能有任何变化,而哪些产品变化,应该申请变更注册,登记事项变更,或许可事项变更登等;
并从发补的角度,分析一些重点常见问题,提醒企业在准备资料的过程中注意规避。


在享用了CCBIO静心准备的茶点后,培训进入到干货更多的第二个议题:注册注意事项及经验交流。
Jason 老师首先从两个完全不同的角度,分析申请企业与技术审评,在注册申报与审批之间的不同立场。
JasonShen接下来的分享,不可谓不风趣,课件就做得妙趣横生。
专业的技术分析,注册申报的经验分享,现场听众的热烈互动,将培训一点点推向高潮。
本次专题讲座得到了与会人员的一致认可,现场人满为患,大家纷纷表示期待一下场专题讲座的举办。之后,CCBio将继续为大家带来产业+干货信息分享,推动医疗企业合规合法创新创业发展,期待行业更多业内同仁的关注和参与。








 沪公网安备 31011502005499
沪公网安备 31011502005499