上篇文章我们已经看了有源类医疗器械与电气安全相关的标签要求,相对于无源器械来说,有源器械往往产品更为复杂,结构安全和电气安全要求较多,因此标识标签系统较为复杂。即使如此,我们也不能忽视了无源器械的标识标签要求,虽然无源器械的标识标签相对简单一些,但是重要性是同等的。在国家局发布的抽查和召回信息中,我们也常常看到标识标签的问题,例如:
施乐辉医用产品国际贸易(上海)有限公司报告,由于涉及特定型号、特定批次产品,存在产品标签信息错误的问题。
瑞毅医疗器械(上海)有限公司报告,由于涉及特定型号、特定批次产品,存在包装内的产品不正确的问题。
厦门敏生医疗科技有限公司报告,由于一次使用采血针(手指用)(批号:20210601)外包装盒注册证号印刷错误。
罗氏诊断产品(上海)有限公司报告,由于部分批号一次性使用末梢采血针的英文标签失效日期与生产日期之间的时长与中文说明书中关于有效期的内容“【贮存条件及有效期】室温保存,4年”存在差异。
以上种种问题多不胜数,常常因为标签标识信息不正确而导致召回,给制造企业带来负面影响。因此标识标签的合规和日常管理应当被给予足够的重视。
后面我们来看看哪些标识容易被我们遗漏。
除了6号令规定的产品基本信息和制造商基本信息以外,通常还应当有以下这些标识信息
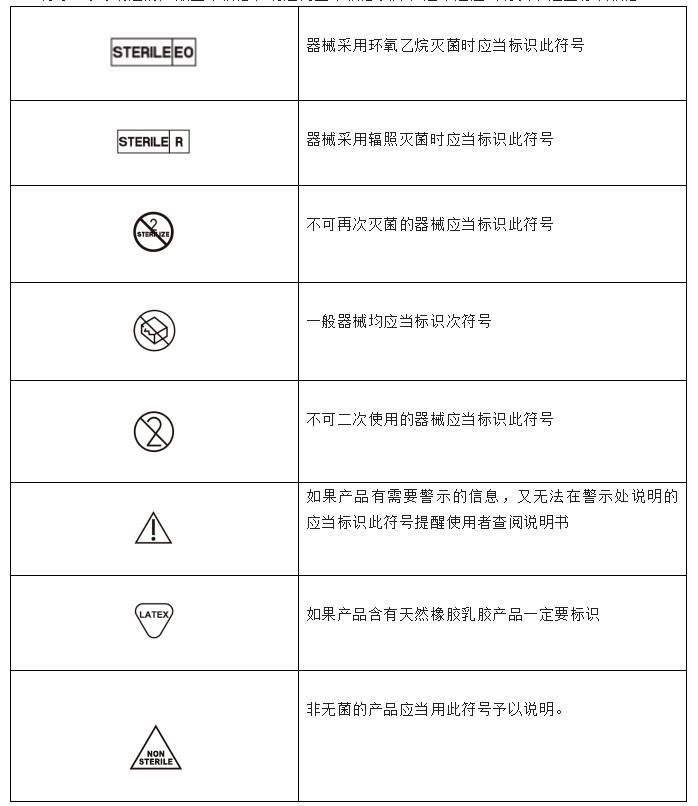
然而,除了标识标签本身的设计问题,无源医疗器械一个产品许多都型号繁多,包装标签共用,经常会出现以下几种问题:
1.产品包装内容物型号规格和标签信息不一致。
2.标签生产日期印刷不正确。
3.标签信息与注册时提交的信息不一致。
4.标签上缺失如规格型号等(预印刷的包装留空后漏补相关信息)。
对于这些问题,第一,我们制造企业应当增强合规意识,标签信息务必应当与注册或备案时提交的信息一致,不要认为提交的标签信息只是给审评老师看看,实际上自己想怎么做就怎么做。
第二,应当在质量管理体系中细化对标签和说明书使用的管理,确保说标识标签信息正确,受控发放到相应产品的生产包装过程中。
第三,加强对标识标签的检验,无论是标签物料还是成品上的标签都应当作为正式的检验工序予以规定。







 沪公网安备 31011502005499
沪公网安备 31011502005499