欧洲医疗器械命名系统(EMDN)
根据医疗器械法规(EU)2017/745(MDR)的第26条和体外诊断医疗器械法规(EU)2017/746(IVDR)的第23条,欧洲医疗器械命名系统(EMDN)旨在支持欧洲医疗器械数据库(Eudamed)的运作。
制造商在Eudamed中进行医疗器械注册时应为医疗器械分配一个EMDN代码并与每个UDI-DI相关联。
它的前身为意大利的CND(Classificazione NazionaleDispositivi medici),最早在三个成员国(意大利、希腊和葡萄牙)中使用并支持欧盟内各欧盟本土制造商和国际制造商的注册。
全球医疗器械术语系统(GMDN)
全球医疗器械术语系统是用于识别所有医疗器械产品的通用名称的目录。
GMDN代码根据ISO 15225编制,主要目的是向卫生当局和监管机构、医疗保健供应商、制造商和其他机构提供可用于交流医疗器械信息和支持患者安全的一套术语系统。
EMDN代码和GMDN代码的适用的国家
欧盟委员会决定不采纳GMDN代码而推广使用EMDN代码。在欧盟,新Eudamed数据库还未开启所有模块,这意味着EMDN代码在Eudamed数据中对设备的准确识别目前仅限于Basic UDI-DI和器械注册这个模块,要到各个功能逐步开放后才能更好地起到数据监管的作用。
大多数IMDRF(全称为International medical device regulatory forum, 国际医疗器械法规论坛)的成员,包括美国、加拿大、澳大利亚、巴西和俄罗斯都使用GMDN。
美国FDA的GUDID数据库登记产品的UDI-DI时也需要录入器械的GMDN代码。
MHRA已为英国向IMDRF申请了独立成员要求对所有低风险产品注册强制使用GMDN代码。
EMDN代码和GMDN代码的适用范围
EMDN代码主要用于支持MDR和IVDR要求的监管目的,因此它还在MDR/IVDR器械文档和技术文档、公告机构进行的技术文档抽样、上市后监督、警戒和上市后数据方面发挥着关键作用分析等。它旨在支持所有经济运营者在MDR/IVDR下的活动,并向患者提供申请产品和市场上可用并在Eudamed注册的所有其他产品的关键器械描述。
GMDN代码适用于:
-
制造商、监管机构和医疗保健机构之间的数据交流;
-
上市后警戒信息的交流;
-
支持医院内部的库存控制;
-
采购与供应链管理。
EMDN代码和GMDN代码的结构区别
EMDN代码将器械分为三个主要级别:
第一级别:类别;
第二级别:群体;
第三级别:类型-如必要时扩展为多个细节层次:(1)(2)(3)(4)(5)
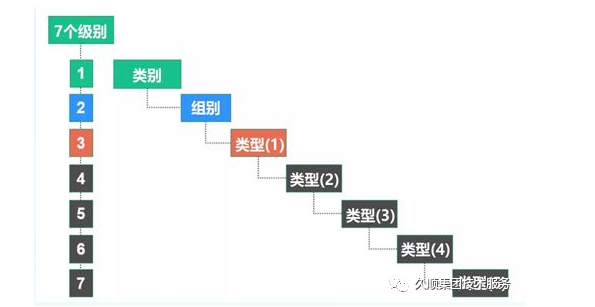
每个字母数字代码以一个表示器械所属的“类别”的字母开头,后跟表示“组别”的数字和一系列表示“类型”的数字,最大位数为13位。
GMDN代码以5位数字表示,可在精确定义的术语名称和定义中交叉引用。
如:
GMDN术语名称:解剖刀、一次性使用
GMDN代码:47569
GMDN定义:操作者用于手动切割或解剖组织的由一段手柄和解剖刀片(非可换组件)构成的无菌、手持、手动的外科器械。刀片一般由高级不锈钢合金或碳钢所制成,而手柄则通常由塑料制成。这是一种一次性使用的装置。
EMDN代码和GMDN代码获取访问方式
EMDN代码可免费在欧盟委员会的MDCG文件网页上访问和下载。
网址链接:
https://www.gmdnagency.org/







 沪公网安备 31011502005499
沪公网安备 31011502005499