美国食品和药物管理局(FDA)正与加拿大卫生部(Health Canada)合作,启动联合eSTAR试点。
本次试点,适用于制造商同时申请美国FDA和加拿大卫生部的医疗器械(不含体外诊断),且名额有限。
eSTAR的内容与适用
一种交互式PDF格式,可指导申请人完成医疗器械提交的准备过程,该模板具备自动化功能(例如:表单构造和自动填充)
其内容和结构如下:
- 对器械与放射卫生中心(CDRH)内部审查模板的补充;
- 与国际医疗器械监管论坛(IMDRF)使用的“医疗器械(不含体外诊断)市场授权目录外部链接免责声明”文件一致;
- 整合多种资源(例:指南和数据库);
- 所有提交部分的指导;
- 自动验证文件是否符合提交要求;
eSTAR免费,所有医疗器械提交者如需向CDRH提交510(k)和De Novo可自愿使用该模板。
加拿大卫生部和美国FDA联合试点
FDA和加拿大卫生部正进行联合测试,测试单一eSTAR的使用情况。
eSTAR可行性将由9名参与者的试点结果决定。
选定的参与者将使用非体外诊断eSTAR,遵循IMDRF医疗器械(不含体外诊断)市场授权目录(nIVD MA ToC)的结构。
eSTAR试点资格要求
参加此试点的人员应具备以下要求:
- 已准备在试点验收后6个月内,向加拿大卫生部和美国FDA提交同一医疗器械的eSTAR。
- 所要求的医疗器械排除:体外诊断器械、组合产品、CBER引导或FDA双重510(k)/CLIA豁免申请。
目前,美国FDA和加拿大卫生部仅接受英文版eSTAR申请,eSTAR提交的法语版本将稍晚提交至加拿大卫生部。
两国医疗器械申请认证收费
FDA费用
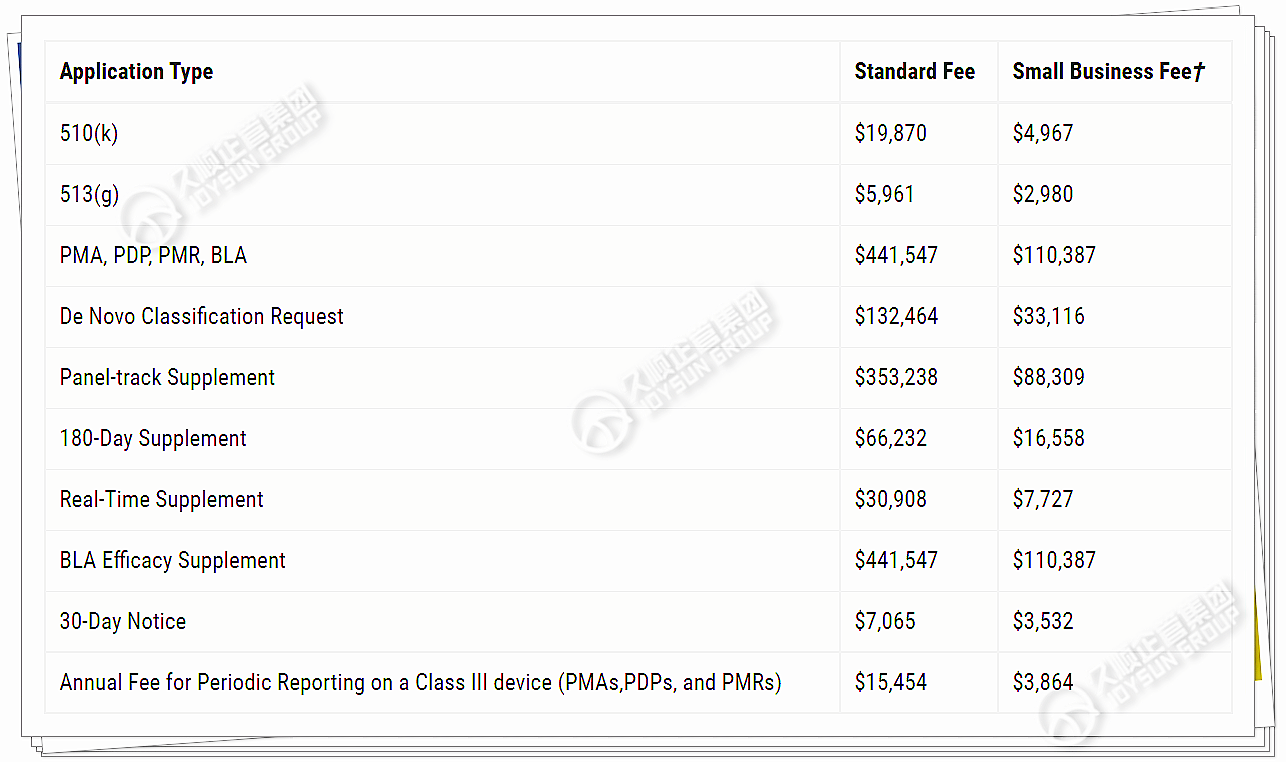
加拿大卫生部费用
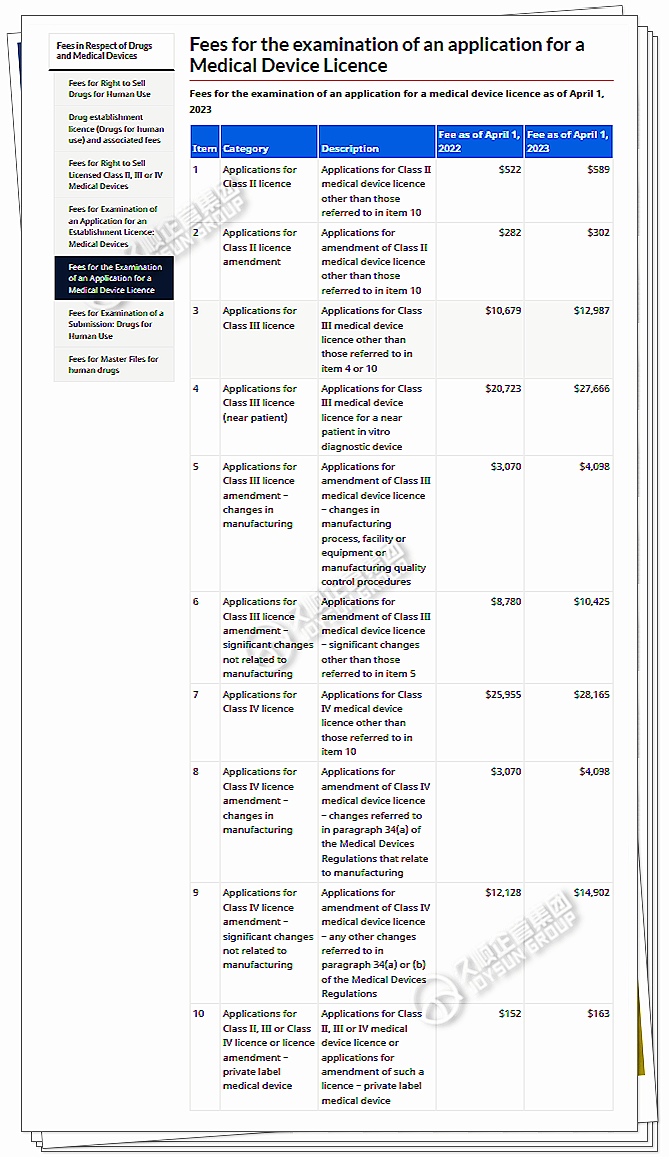
小微企业费用:适用经CDRH认证的小微企业。
久顺观点
从eSTAR入手,这一自动化文件提交工具,同时适用美国和加拿大这两个邻国,或许释放了两国医械文件互认的信号,会不会是两国医械产品申请互认的开端或尝试呢?
>> 后续发展还请持续关注【久顺企管】公众号!
如需申请创建eSTAR账户,可咨询久顺提供相关服务。
√ 更多FDA注册服务,认定【久顺企管】准没错!
近30年全球合规技术专家、资深美代,【久顺企管】配备能力&资历俱佳的技术团队,成员超80%本科、硕士、博士比例,普遍具备海外留学经验,可无障碍英语口语和书面交流,呈献一站式快捷高效的FDA合规服务:FDA法规符合性咨询及培训、FDA证书获取、FDA验厂等。
√ FDA多重优势服务项目:
1. FDA官网企业账户年度注册、产品列名、产品上市前批准(510K\510K豁免),维持账户活跃;
2. 510(K)、Pre-submission、De Novo分类请求的文件编制、递交及进度跟踪服务;
3. 邓白氏码查询、激活获取;
4. 产品分类、产品代码、等同产品的查询配对;
5. 申请创建FDA UDI-DI、GUDID账户;
6. GUDID数据库录入医疗器械关键信息;
7. QSR820体系建立维护、FDA验厂咨询等。









 沪公网安备 31011502005499
沪公网安备 31011502005499