【欧盟篇】
医疗器械唯一标识(UDI),发码机构GS1效率提升!
欧盟MDR的IIa、IIb、III类-可重复使用产品、IVDR的Class D产品将在今年5月26日开始实行UDI数据载体。
发码机构是UDI唯一性的重要保证,在UDI系统实施中扮演着不可忽视的角色。美国、欧盟等大部分国家和区域均认可全球物品编码组织(GS1)发码机构。
之前收到不少客户反馈:申请GS1周期很长,但在2023年,GS1做出重大变化。
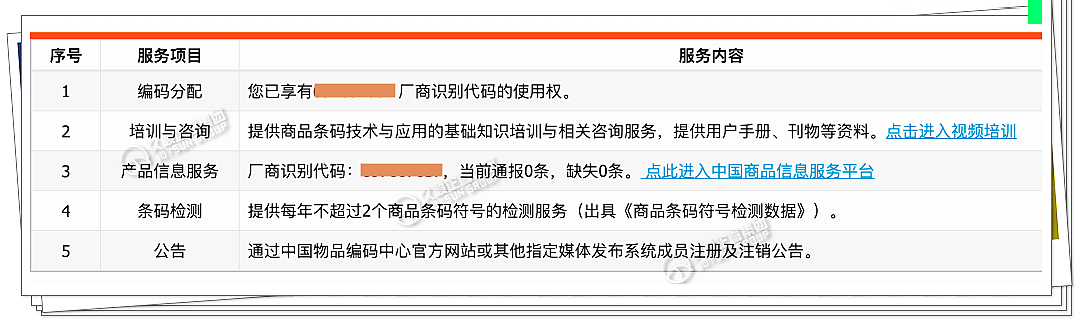
- 客户完成GS1中国申请流程后,会出现如图所示的一个对话框,显示有“EAN码”。
- 企业已不需要如往常那般等待2周时间,申请周期被大大缩短。

欧盟MDR过渡期延长,靴子迟迟未落地!
此前,久顺已介绍欧盟为延长MDR过渡期所提出的若干修正提案。
客户对此反馈热烈,纷纷咨询公告机构和欧代,询问延期操作的可行性,久顺也在过年期间收到不少询问,并第一时间询问了主管当局。
该项提案此前已被欧盟委员会列为紧急提案,将原本8周的提案讨论期缩减为1周,目前提案讨论期已经结束,各欧盟成员国已将意见反馈至欧盟委员会处,并定于将在2月13日-16日的欧盟委员会全体会议上投票表决此项提案。
对于欧盟委员会关于MDR过渡期延长的提案,有国家表示赞成,也有国家仍主张MDR/IVDR法规推行,因为其考虑到MDD证书延期对已获得MDR证书制造商是不公平待遇。
截止目前,尚未出现折中方式,以平衡成员国政府和欧盟委员会之间的矛盾和需求。
因此,当前大部分主管当局都未能批准企业MDD证书延期的申请。
【美国篇】
美国FDA审核周期,有望缩短!
FDA将于2023年起加快审批速度,设定绩效目标!
数月以来,FDA一直致力于实现其绩效目标,从2023年开始,FDA预计将上市前审批提交PMA审核周期由290天缩短到285天。
FDA预计将上市前通知510(k)的审核周期设定为128天,从2025年开始缩短至112天。
久顺企管已通过FDA注册的操作实践,切实体验到FDA效率的显著提升,今年1月份递交上市前通知510(k)申请后,例如:以往7天后才会收到受理通知,现在只需24-48小时就可收到。
美国FDA,电子文件系统确定生效日!
电子提交模板(eSTAR)是目前唯一可用的电子提交模板,以方便为510(k)电子提交做准备。
目前,FDA尚未确定任何适合豁免510(k)电子提交要求的特定情况,并无批准豁免请求的计划。
FDA将2023年10月1日确定为510(k)电子提交要求生效的日期。
而且,2023年10月1日之前FDA仍计划接受电子存储介质形式和纸质资料。
2022年10月1日至2023年9月30日的一年时间为过渡期,在此期间申请人可自由抉择是否使用510(k)电子提交。
久顺企管已在今年1月以电子提交模板(eSTAR)形式递交上市前通知510(k)申请,很快便收到来自FDA文控中心(DCC)的邮件回复,免去了线下纸质版文件邮寄的麻烦。
FDA小微企业申请激增,引发“爆单”!
久顺企管已用较多篇幅介绍小微企业Small Business的申请攻略,不少企业由此寻求久顺协助申请。
除了中国地区,其他国家制造商也加入了“薅羊毛”的队伍,一时间FDA小微企业申请“爆单”!不少企业在去年12月时都会收到这样的邮件(如图):
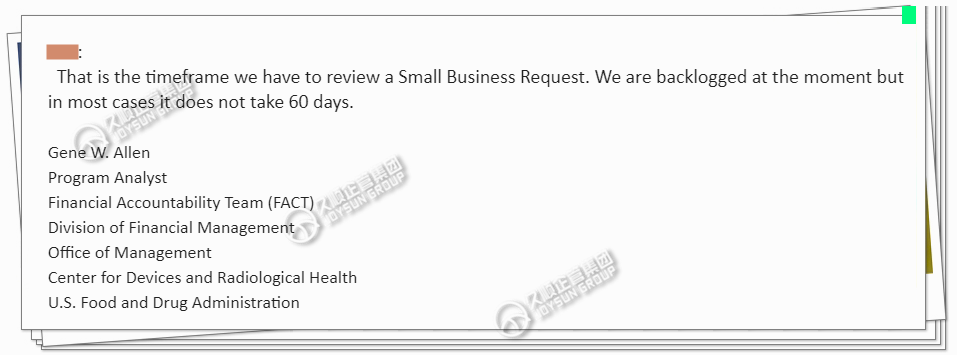
邮件中提到需要60天,此周期大大延迟。
然而,久顺依旧有能力帮助企业缩短时间,详情欢迎咨询久顺企管。
对于已获得申请表P2上税务局盖章的企业,获得小微企业号是迟早的事情,只需耐心等待!
对于大部分客户,都无法在申请表P2上获得国内税务局盖章,久顺及时询问FDA后得知:未获税务局盖章情况下,企业需提供证明材料清单,例如:国家税务局出具的拒绝证明表格3602A第三节的声明,必须是英文,且需要注册翻译官声明后才可翻译(注册翻译官不能是公司员工)。
# 如何从容高效应对监管变化? #
→【久顺企管集团】愿成为您注册路上的忠实伙伴!近30年全球合规技术专家、资深欧代+美代,美国、荷兰、英国、中国均设公司,每日无缝链接欧美中实时信息,配备能力&资历俱佳的国际技术团队,超80%本科、硕士、博士比例+海外留学经验,无障碍英语口语和书面交流,呈献一站式快捷高效服务:
【FDA】法规符合性咨询及培训、FDA证书获取、QSR820体系建立维护、FDA验厂、510(K)\Pre-submission\De Novo分类请求的文件编制\递交\进度跟踪。
【MDR\IVDR】 辅导企业升级体系以满足欧盟合规性,帮助企业短时间建立运行质量管理体系,编写技术文档,辅导通过公告机构审核,快捷获取CE证书。









 沪公网安备 31011502005499
沪公网安备 31011502005499