动态1
鼓励公众报告新冠抗原自测结果
美国时间2023年2月6日,美国食品和药物管理局FDA更新简易分步指南,包括:要求公众向MakeMyTestCount.org网站报告OTC家用新冠检测抗原试剂的结果信息。
MakeMyTestCount网站通过美国国立卫生研究院NIH快速诊断技术项目而开发,FDA鼓励大众在每次使用家用新冠检测试剂盒时,在网站自愿匿名报告阳性或阴性检测结果。
网站收集的数据可帮助公共卫生部门了解病毒传播速度,也有助于公共卫生部门评估和修改其在当地社区、州或全国范围内对新冠肺炎的应对措施。

动态2
批准首个CLIA豁免呼吸道传染病联检产品
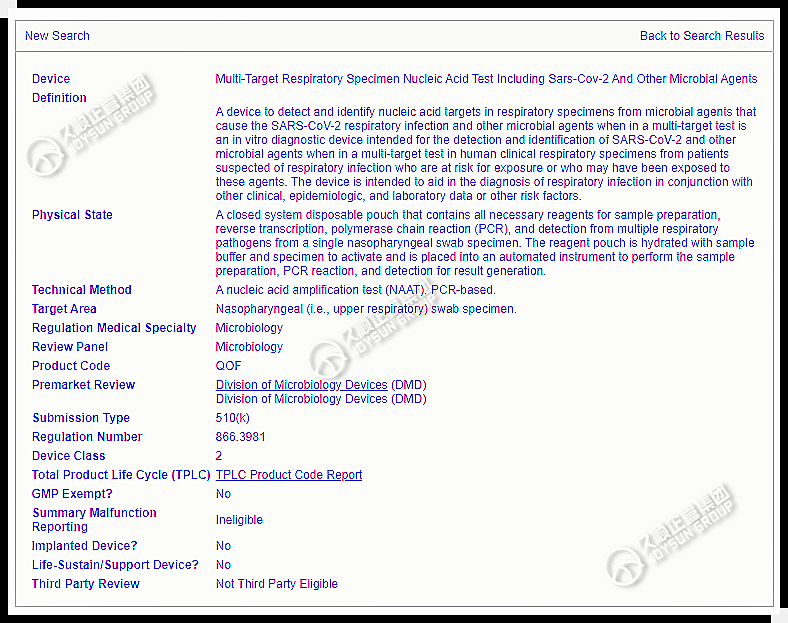
美国时间2023年2月3日,FDA批准一款体外诊断产品,名为BioFire SPOTFIRE Respiratory(R)Panel,用于同时检测和识别疑似感染新冠肺炎与其他呼吸道病毒及细菌感染。
该测试通过510(k)和CLIA豁免途径进行审查,使其成为第一个CLIA豁免通过的呼吸道传染疾病联合检测产品。
临床实验室改进修正案CLIA豁免,允许简单医疗设备的制造商放弃所需的测试,前提是该测试可被确定为“简单”,或其结果的可能错误与无关紧要的风险相关。
该产品已在FDA官网上公示,K号为K213954,参考的Product code为QOF。
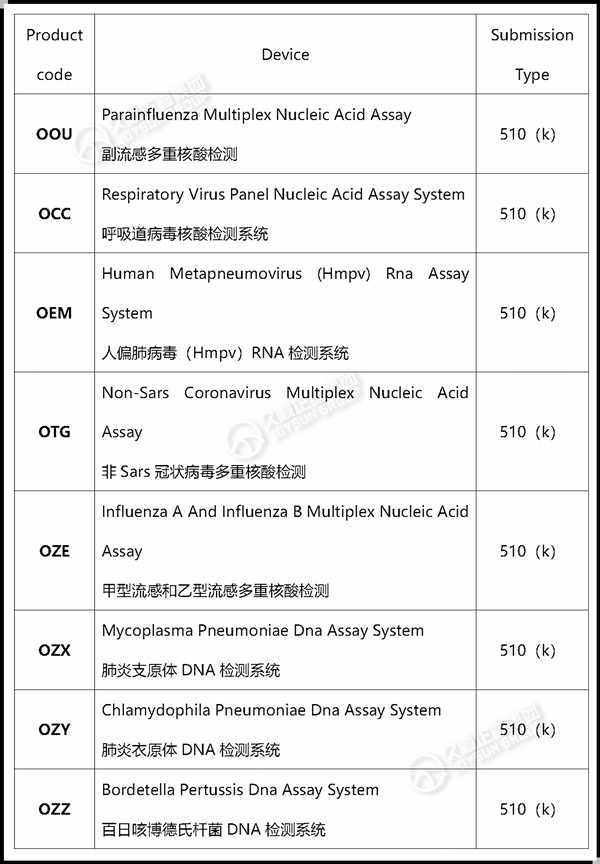
久顺企管针对 呼吸道疾病Product code 整理如下:
观 点
510(K) is back !
据消息观察,目前EUA紧急使用授权政策尚不明朗,虽通道仍未明确表示关闭,但多种迹象表明EUA审核或已处于停滞状态,而新冠、呼吸道等检测产品回归510K,终将是正解!
√ 510(K):FDA上市前批准的正规审核途径,久顺企管具备丰富成功案例!
→ 欢迎联络【久顺企管】近30年全球合规技术专家、资深美代,配备能力&资历俱佳的技术团队,成员超80%本科、硕士、博士比例,普遍具备海外留学经验,可无障碍英语口语和书面交流,呈献一站式高效率FDA合规服务:法规符合性咨询及培训、证书获取、性能研究方案编写、临床性能方案制定、临床试验实施、FDA验厂等。
√ 510(K)之外,具体优势服务项目有:
1. FDA官网企业账户年度注册、产品列名,维持账户活跃;
2.Pre-submission、De Novo分类请求的文件编制、递交及进度跟踪服务;
3.邓白氏码查询、激活获取;
4.产品分类、产品代码、等同产品的查询配对;
5.申请创建UDI-DI、GUDID账户;
6.GUDID数据库录入医疗器械关键信息;
7.QSR820体系建立维护、FDA验厂咨询等。









 沪公网安备 31011502005499
沪公网安备 31011502005499