
2025年6月FDA发布《组合产品UDI要求指南》的最新草案,重点区分三类组合产品。每种类型的UDI要求各有不同,值得注意的是:器械主导的产品必须使用UDI、药品/生物制品主导的产品使用NDC、由于共包装产品最复杂需同时考虑整体和组件的标识。以下带来该指南的详细解读。
一、核心适用范围
组合产品类型:
·单一实体(如预充注射器、药物支架)
·共包装(如手术套件+药品)
·交叉标注(分开放置,但必须配套使用)
监管对象:含器械成分的组合产品制造商(贴标商)
二、UDI要求关键规则
1.UDI的豁免情形
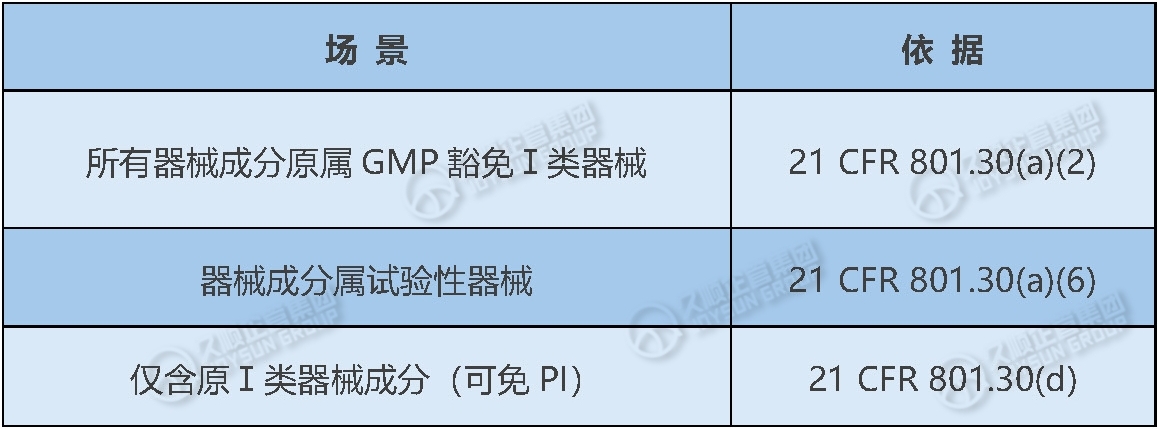
注意:豁免需满足严格条件,变更预期用途可能丧失豁免资格。
2.必须应用UDI的场景
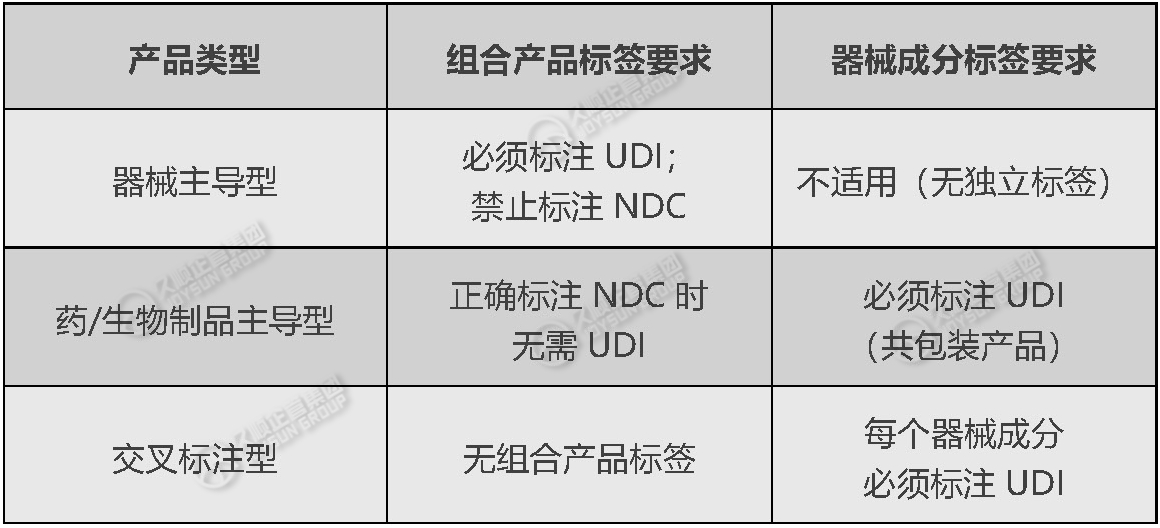
3.特殊处理
·共包装产品:
若整体标注UDI→内部器械成分可免单独UDI;
若标注NDC→每个器械成分需UDI(推荐直接标在组件上)。
·便利套件(如灭菌器械包):套件整体标注UDI→内部组件可豁免UDI。
三、FDA建议
1.标识清晰化:
UDI和NDC被同时标注时,需作明确区分(例如:使用UDI符号);推荐采用ISO-15223-1:2021标准符号。
2.供应链责任:
采购已贴UDI的器械成分,其中组合产品商无额外UDI责任;需验证供应商GUDID数据提交(通过Access GUDID)。
3.数据库提交:
贴标商需向GUDID提交数据(需FDA授权号/列名号);禁止非贴标商提交。
四、典型场景示例
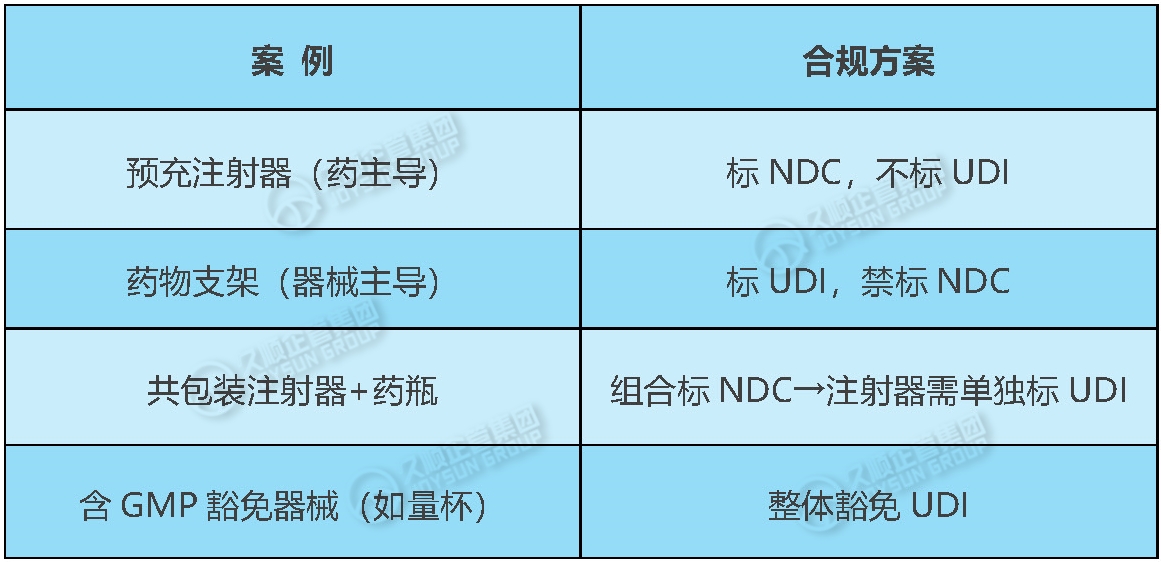
五、合规行动4步走
1.确定产品类型:通过RFD/Pre-RFD申请FDA分类确认;
2.检查豁免资格:核查器械成分的原始分类(GMP豁免/I类);
3.标识策略:器械主导→申请UDI、药/生物主导→申请NDC并确保器械成分贴UDI;
4.GUDID提交:开通账户(需FDA授权号);提交UDI-DI及PI数据(批次/序列号/有效期等)。
注意→草案时效性:本文件为2025年6月草案,意见征询期截至发布后的90天,最终版可能被调整。








 沪公网安备 31011502005499
沪公网安备 31011502005499