新闻法规
IVD厂商利好:中马监管互认试点公告,明确申请资质及提交要求
[2025-07-31]
马来西亚医疗器械管理局MDA发布公告《马来西亚-中国医疗器械监管互认计划的实施(试点第一阶段:2025 年 7 月 30 日至 9 月 30 日)》。
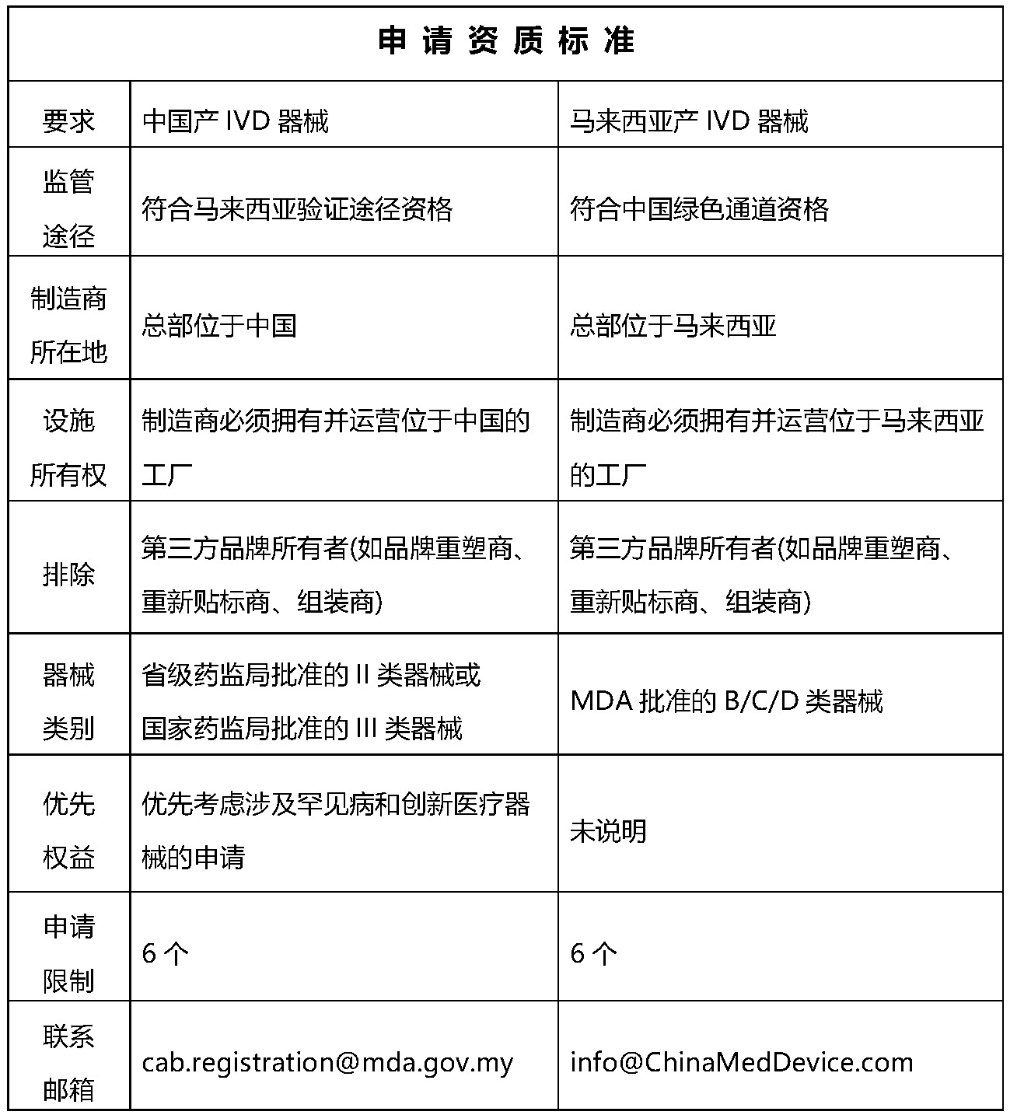
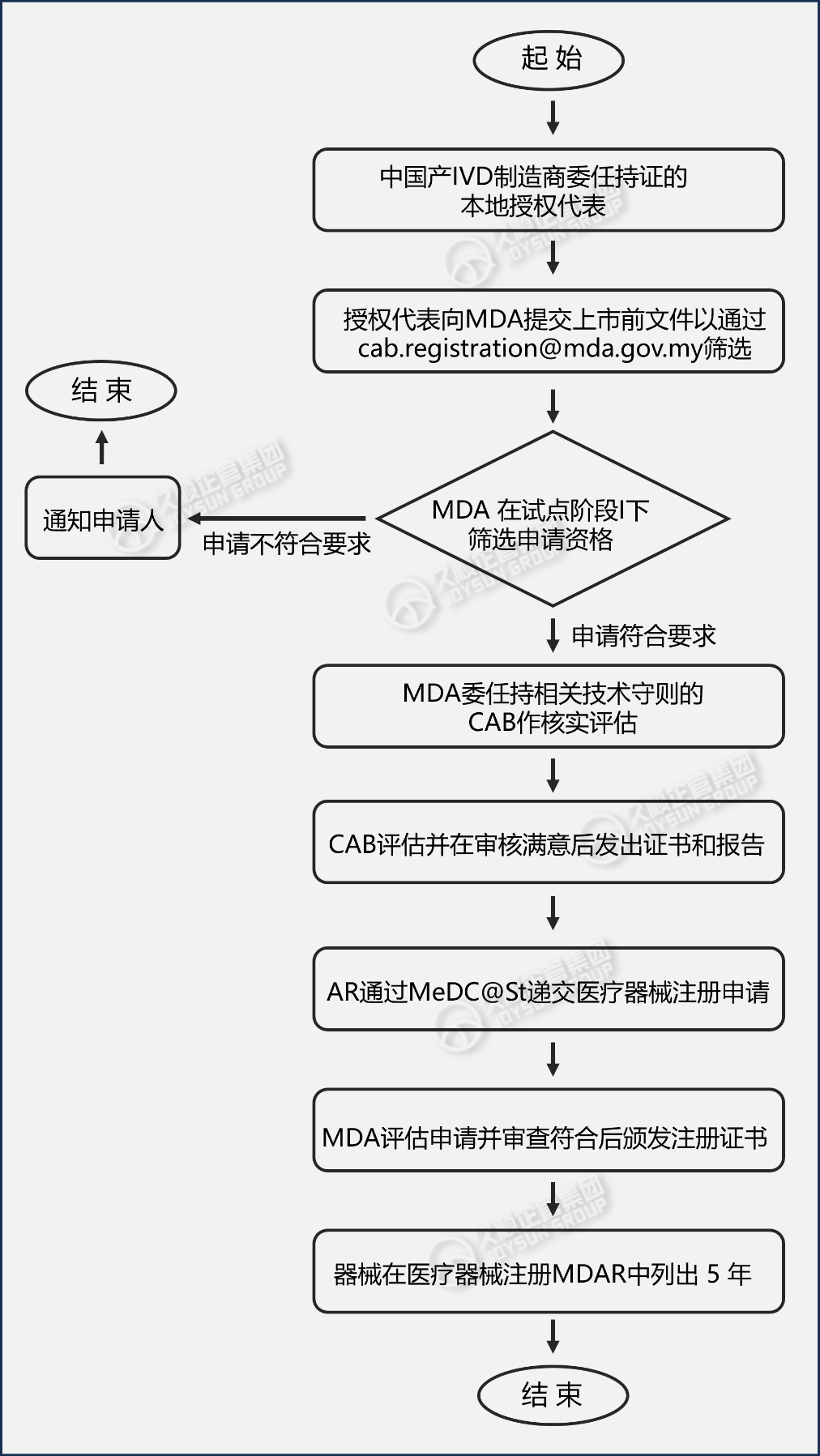
解释说明:
1. CAB为合格评定机构
2. AR 为授权代表,其必须持有 MDA 根据第 737 号法案颁发的有效场所许可证。
3. 提交必须包括以下文件(仅处理完整的申请):
•质量管理体系QMS:ISO 13485、MDSAP、QSR(FDA 21 CFR 第 820 部分)或日本厚生劳动省条例169
•医疗器械信息:器械名称、预期用途、分类、规则和分组
•CSDT文档:执行摘要、安全和性能基本原则EPSP、设计验证和确认摘要、临床前和软件验证研究、临床性能、标签、使用说明IFU、手册、风险分析、制造过程信息
•上市后监督PMS
•符合性声明DoC
•省药监局II类注册证书或国家药监局III类注册证书
详细要求参阅MDA/GD/0070指导文件:通过验证程序进行合格评定的提交指南 (MeDC@St)
来源:马来西亚医疗器械管理局(MDA)官网
>>医疗器械注册,久顺是您不二之选! 始创于1996年,近30年全球合规技术专家,西班牙\荷兰\英国\美国\中国均设公司,专注无菌\非无菌\植入\有源\体外诊断等医疗器械领域,具备丰厚的质量体系、临床试验、产品注册咨询管理和技术服务经验,护航产品全球畅行无阻。

【返回】







 沪公网安备 31011502005499
沪公网安备 31011502005499