一、标准编号及标准名称
GB/T 44672—2024《体外诊断医疗器械 建立校准品和人体样品赋值计量溯源性的国际一致化方案的要求》国家标准于2024年9月29日发布,2025年4月1日实施。本标准等同采用国际标准ISO 21151:2020,由国家药品监督管理局提出,全国医用临床检验实验室和体外诊断系统标准化技术委员会(SAC/TC136)归口。
二、标准制定背景
在不同实验室使用不同的体外诊断医疗器械(IVD MD)测定同一人体样品的同一被测量应具有等效的数值结果。只有当无论使用何种IVD MD,其检测结果都等效,并能基于统一决定限解释实验室结果以指导临床诊断和治疗决策时,实践指南才可能有效实施。检验医学已采纳IVD MD校准向高等级参考标准计量学溯源的原理,作为实现同一被测量不同IVD MD、不同测量时间或不同测量地点结果等效的基础。ISO17511:2020描述了参考测量系统的6种校准层级结构(参见ISO17511:20205.2至5.7中的情形),它们满足校准向高等级参考标准计量学溯源的要求。对情形5.6中(适用于人体样品中的被测量由国际一致化方案定义的情况;此种情况下,没有国际认可的参考测量程序,没有一级参考物质,没有约定参考测量程序或参考物质,也不能溯源到SI单位)的被测量,在技术上很难研制高等级参考标准,因此需要一种基于约定方案的标准化路径,以实现两种或以上IVD MD结果等效。为此,制定本标准以规范此类一致化方案的建立和实施,填补现有溯源体系的空白。
三、标准适用范围及主要内容
(一)适用范围
适用于无参考测量程序、无适用有证参考物质或国际约定校准品的被测量;适用于存在有证参考物质或国际约定校准品,但因与人体样品缺乏互换性等原因不适用的情况。
其核心是为ISO 17511:2020中情形5.6的被测量提供一致化方案框架,定义该类被测量的最高水平计量溯源性无参考测量程序、有证参考物质或国际约定校准品的被测量(对应ISO 17511:2020中的情形5.6),通过一致化方案实现两种或以上IVD MD间结果等效。
(二)主要内容
GB/T44672—2024/ISO 21151:2020《体外诊断医疗器械 建立校准品和人体样品赋值计量溯源性的国际一致化方案的要求》共有6个章节,1个附录,分别从范围、规范性引用文件、术语和定义、缩略语和符号、一致化方案的要求、使用说明中提供的计量溯源性信息6方面对建立校准品和人体样品赋值计量溯源性的国际一致化方案进行了规定。
1.术语与定义
明确 “一致化”“一致化参考物质”“国际一致化方案”等核心术语。如“一致化”指通过国际共识方案实现不同IVD MD结果等效,且溯源至该方案而非SI单位。
2.一致化方案的核心要求
(1)被测量:需按ISO 17511:2020定义被测量,确保检测目标清晰;
(2)IVD MD的纳入/排除标准:基于精密度、回收率、选择性等性能特性,结合临床决策影响评估,明确哪些IVD MD可参与方案;
(3)一致化参考物质:规定参考物质的制备(如人体样品盘、混合样品)、均匀性、稳定性、互换性(与人体样品的一致性)要求,确保其适用性;
(4)量值赋值与校准改进:描述参考物质的赋值程序(如统计方法、算法),要求制造商通过校准层级调整(如修正终端用户校准品赋值)实现结果一致化;
(5)有效性与可持续性:需通过独立样品验证方案有效性,并制定长期维持策略(如替换参考物质批次、监测结果稳定性);
(6)新IVD MD的纳入:需明确未参与初始方案的IVD MD(如性能改进后或新上市产品)的一致化流程。
3.计量溯源性信息
要求制造商在使用说明中明确校准层级采用的一致化方案及负责机构,保障终端用户的知情权。
4.资料性附录
提供一致化方案的工作示例(以“R 肽”检测为例),演示从参考物质制备、赋值到结果验证的全流程,有助于对标准的理解和后续执行。
5.一致化方案流程图
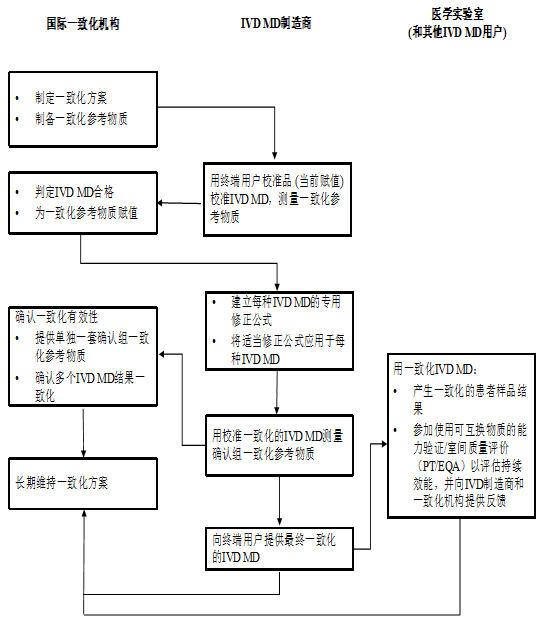
四、标准实施意义
1.提升临床检验质量:通过统一校准品赋值和结果溯源路径,降低不同IVD MD间的系统误差,确保不同检测系统对同一患者样品的测定结果可比,减少因结果差异导致的误诊、漏诊,提升医疗质量。
2.支持公共卫生决策:确保跨实验室、跨地区的检验结果等效,为疾病筛查、疗效监测等公共卫生行动提供数据支撑。
3.促进产业升级:规范体外诊断产品的研发与生产,推动制造商采用统一的溯源逻辑,促进行业技术升级;推动IVD MD制造商优化校准体系,提升产品国际竞争力,助力我国体外诊断产业与国际标准接轨。
4.保障患者安全:减少因结果不一致导致的误诊或治疗不当,为临床精准诊疗提供技术保障。
5.行业和国际影响力:通过等同采用ISO标准,实现与国际接轨,助力我国体外诊断产品的国际化及检验结果的跨境互认;为监管机构提供评估IVD MD性能的统一标准,强化对体外诊断产品的质量管控,保障患者安全。
本标准的实施将进一步完善我国体外诊断领域的标准化体系,对推动检验医学规范化、国际化发展具有重要意义。
来源:中国食品药品检定研究院
声明:文章为转载,其版权归原作者所有。转载仅用于分享,若涉及文章版权等问题,联系我方删除!
#国内注册要快&还要好?认准久顺就对了!
>>【久顺企管集团】医械注册的加速引擎!近30年全球合规技术专家,中国\西班牙\荷兰\美国\英国均设公司,擅长产品注册全程辅导、技术文档编写、质量体系建立完善及咨询等服务,以及CE/FDA/UKCA/CFS等证书办理,具备优厚的咨询管理和技术服务经验及能力,护航产品全球范围高速畅行。








 沪公网安备 31011502005499
沪公网安备 31011502005499