新闻法规
IVD制造商收藏:欧盟IVDR CE公告机构审核全过程拆解
[2025-09-08]
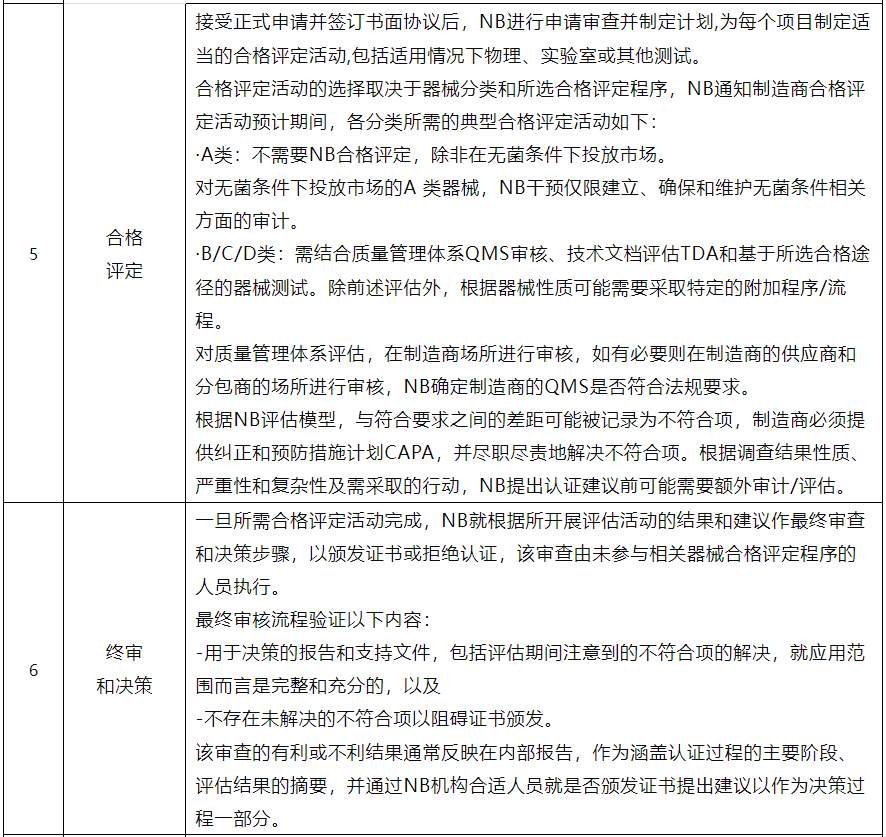
Team-NB欧洲公告机构协会发布共识文件,旨在详述制造商根据IVDR法规向公告机构NB申请体外医疗器械认证的申请前、申请流程。该文件通过审查各Team-NB 成员的申请流程和相关文件并在可能情况下协调流程而制定,适用过渡至IVDR的遗留器械、新上市且此前未根据指令认证的医疗器械,并简要介绍申请流程结束后的认证活动,可使得公告机构能在更短时间内更高效处理申请。


→欧盟CE·久顺服务合规✔可信✔
√选择久顺就是选择成功!始创于1996年,西班牙\荷兰\英国\美国\中国均设公司,近30年全球合规技术专家。提供全程高效的欧盟合规服务:√CE注册取证√技术文档编写 √合规策略 √体系辅导 √上市后监督咨询 √近20年资深欧代 √编撰临床方案设计\临床试验方案 √收集\整理\分析试验原始数据并出具临床试验报告等。
√久顺已与欧洲各大主流实验室和医院建立合作渠道,提供临床性能研究、可用性研究、上市后临床跟踪研究等服务。

【返回】







 沪公网安备 31011502005499
沪公网安备 31011502005499