新闻法规
FDA连发12份警告信:均为未注册和列名违规,面临没收/禁令风险
[2025-12-19]
按法案规定:医疗器械制造商必须每年开展FDA注册,即所有美国国内和国外的医疗器械生产企业每年于10月1日-12月31日期间,以电子方式向FDA提交企业注册信息和其医疗器械清单。
然而FDA记录显示:本次12份警告信中的医疗器械或其材料(皆为束胸产品)全都未进行2026财年的器械注册和列名。
针对上述的企业违规行为,FDA要求械企立即采取行动以解决处理问题,FDA表示可能在不另行通知的前提下实施监管举措(不仅限于没收相关产品和颁发禁令)。
FDA指出:械企必须在收到该警告信后15个工作日内,使用书面形式告知企业为解决以上违规问题所采取的具体举措,并阐释企业预防类似违规重现的计划。械企应附上其所实施的整改措施有关文件;若整改措施需分期落实则应提供详细时间安排;若械企无法于15个工作日内完成整改,则应解释延迟原因和预计完成的时长;若企业认为其产品未违规则需在回复中陈述理由并提供对应的支持性资料。
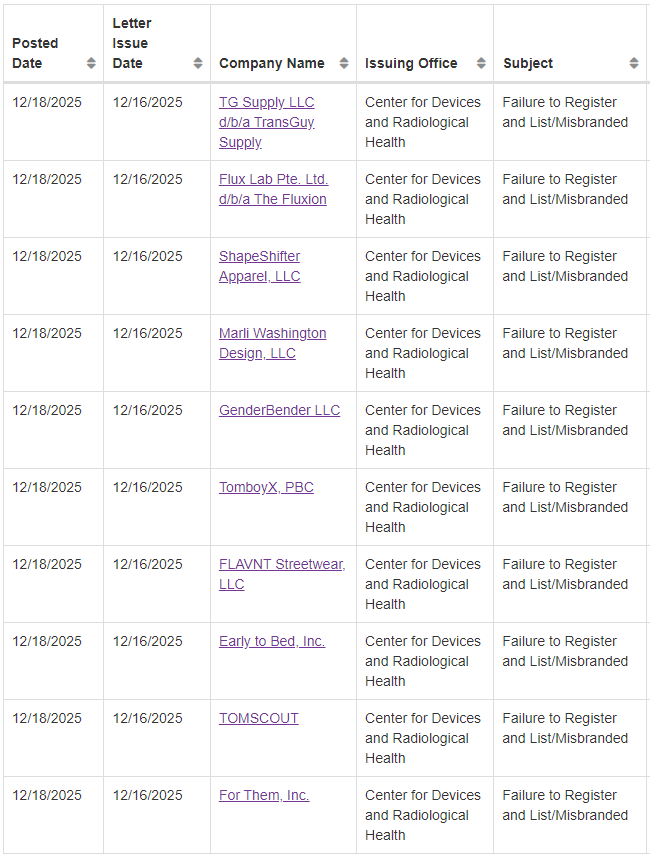
本次警告信涉及的12家违规企业名单如下↘

*FDA注册与列名→交给久顺√快√准√好! 30年全球合规技术专家&资深美代,成员超80%本科\硕士\博士,丰富的海外留学经验,无障碍英语口语\书面交流,一站式高效率FDA合规服务:
· FDA官网企业账户年度注册、产品列名,维持账户活跃;
· 510(k)、Pre-submission、De Novo分类请求的文件编制、递交及进度跟踪服务;
· 邓白氏码查询、激活获取;
· 产品分类\产品代码\等同产品的查询配对;
· 申请创建UDI-DI\GUDID账户及数据库录入;
· GUDID医疗器械关键信息录入;
· 质量体系建立/维护/升级、FDA验厂咨询等。

【返回】







 沪公网安备 31011502005499
沪公网安备 31011502005499