2023年1月,全国医疗器械监督管理工作会议提到“扎实开展自制试剂试点”,继2021年《医疗器械监督管理条例》正式确定LDT作用后,再次强调LDT试点的推进。
在政策的支持下,各地LDT试点随着行业发展需求,陆续落地。其中上海市遴选确定40家公立医疗机构为高质量发展试点单位,鼓励有条件的市级和区级医院开展自行研制体外诊断试剂试点。

部分城市LDT政策汇总(来源:上海市人民政府网)
LDT(laboratory developed test),即实验室自建检测方法、或实验室研发诊断试剂,与IVD区别主要在于服务对象。
LDT主要对象是没有检测能力的医院、ICL、药企,甚至保险公司;
IVD服务对象则是有检测能力的医院、第三方检测机构,除了用户外,对实施主体医疗器械厂商,有严格的监管模式,需要经过NMPA/FDA等主管部门的注册审批。
临床检测项目发展日新月异,传统注册路径并不完全适用,以肿瘤诊断为例,因申请注册证所需资金、周期成本较大,一般需要3~5年时间,对企业早期产品推进是较大障碍;前沿技术的发展也快于注册标准的迭代,使得先进检测方法不能充分应用于有需求的患者;国内三甲医院检测项目约800项,而发达国家同级别医院项目为3000~4000项,其中70%通过LDT实现,国内院方无法将国际验证有效的检测应用于临床,造成三方痛点。
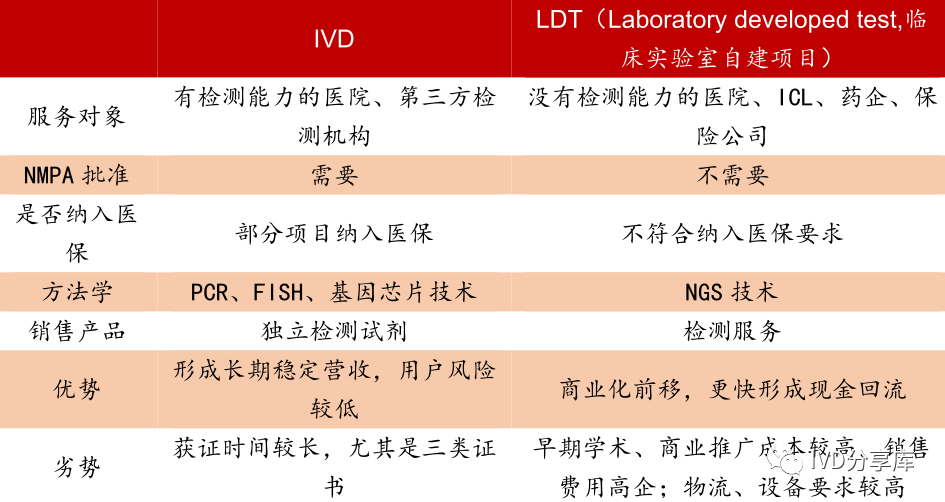
IVD和LDT商业模式区别(来源:医疗器械监督管理条例)
LDT与IVD两种形态可互相赋能并为不同场景、需求提供个性化服务,多数企业也选择同时布局。产品在通过立项、研发后即可进行LDT资格申请并进入市场,为靶标的快速应用提供便利,厂家端较IVD而言更容易尽快形成现金回流,但LDT需要较高的推广成本和人力费用,也导致该模式下销售费用高,叠加LDT模式对物流条件、资源设备等要求较高,对小规模企业业绩更易造成压力。
参考美国市场,LDT监管最早始于1976年《医疗器械修正案》,明确 IVD归属FDA管理,但并未对LDT部分进行细化;1988年,医疗保险和医疗补助服务中心(CMS)根据临床实验室改进修正案(CLIA)承担LDT实验室管理工作。技术的发展以及监管机构的角力,使得IVD和LDT的界限越发模糊,形成FDA监管产品,CMS监管实验室的框架。
诊断行业的快速发展,对LDT模式的普及有较强需求,政策端的持续助力,或将加速LDT在各地的普及。我们认为,LDT的推广,将对产业链不同环节的企业,带来利好。
设备端:临床项目的增加,或将带动仪器采购需求,设备端作为产业链最早一环,有望充分享受LDT模式带来景气度提升。
试剂端:前沿项目的应用,有助试剂公司早期资金回流,并加深与头部医疗机构的合作,为后续项目的合规注册积累临床数据。
下游端:因院内医疗资源相对稀缺,部分项目外包将获得更大效益,LDT模式的普及,有望为第三方医学实验室引流,带动特检业务发展。
来源:IVD分享库
声明:转载文章仅用于学习交流分享,不代表我方观点,若涉及作品版权等问题,请联系我方!









 沪公网安备 31011502005499
沪公网安备 31011502005499