欧盟CEP/COS变更和更新
一、项目介绍
1.名称:Revisions/renewals of certificates of suitability to the European Pharmacopoeia monographs, 翻译为COS/CEP变更/更新等。当生产商取得COS证后,涉 及到地址变更,工艺变更,药典更新,年度更新等时,需要向EDQM提交相关修订/更新申请,审评通过后获得接受意见函或者更新的COS证书。
2.现状:EDQM对获得CEP证书的原料药的变更/更新等,实行两轮评估制度,见决议AP CSP(07)1
二、CEP变更/更新等申请流程
原料药生产商取得COS/CEP证书→持有人发起或EDQM发起→EDQM评估(30,60,90天) →补充反馈→更新 cos 证书或接受意见函。
三、常见问题
1. 变更的分类?
按对终产物质量的影响来分,主要包括:年度通知变更(annual notification, AN),即时通知变更(immediate notification, IN),大变更(major, MAJ),小变更(minor, MIN)。
2. 如何进行药典更新?
药典更新是由EDQM发起的,要求90天内进行递交。
涉及到药典修订或者其他强制性法规要求由EDQM发起。
3. 变更列表包括哪些方面?怎么递交?
1)行政类变更;
2)质量改变;
3)TSE改变;
4)使用一个CEP来申请另一个CEP。
EDQM上对于每种变更的涉及到的具体变更内容,进行了分类,并对具体需要提供的资料做出了说明。参考PA/PH/CEP (04) 2, 6R
4. 联系人发生了变化,如何进行变更?
在CEP申请周期内,联系人发生变更是免费的,可以通过两种方式进行变更:1).在与需要进行变更或更新申请时在application form的table 2.2里面进行说明,2).在EDQM网站上下载“Change of contact details for a CEP “ 进行填写,通过CESP进行递交。
5. CEP证书的更新?
首次获得CEP证有效期5年,到期前6个月申请更新,申请更新时附带进行小的变更是允许的,不允许大的变更,到期后更新了无限期。
6. 变更申请包括哪些内容?
变更文件包括:1)模块1:说明信,申请表,参考EDQM修订/更新指南对于每个变更的描述,CTD module3的之前批准内容和更新内容对比表, 通知类变更还应表明符合条件。
每次需要提供批数据,包括:最新的EP标准的质量标准,生产地址、时间和批量,检验报告等。2)模块3:每个涉及变更的部分要更新,变更部分要重点标记。
7. CEP变更/更新费用多少?
| Reference | Item | Price |
| CEP 004 | Renewal | 1500 € |
| CEP 009 | Notification | 1000 € |
| CEP 005 | Minor revision | 1500 € |
| CEP 019 | Grouped revisions (affecting several dossiers) | 2000 € |
| CEP 020 | Major revision ( may include minor changes and notifications ) | 2000 € |
| CEP 006 | Transfer of Holdership | 1500 € |
| CEP 015 | Evaluation of sterility data | 3000 € |
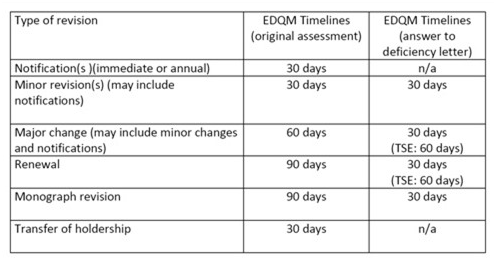
8. CEP变更/更新等EDQM官方评估时间表
四、久顺企管集团(中国 英国 爱尔兰)的服务流程
发出《客户资料表》→评估(电话、邮件、现场)→出具合同和计划表→签订合同→现场诊断→分析原因→COS更新培训→成立COS变更/更新工作小组→指导客户准备申报所需中文资料→翻译制作英文文件通过CESP→提交COS变更/更新资料给EDQM→保持与官方的联络→指导完成缺陷补充等资料→COS更新。







 沪公网安备 31011502005499
沪公网安备 31011502005499