美国药品DMF制作与归档
一、项目简介
(1)名称:药物主文件,即Drug Master File (DMF),是呈交FDA的存档待审资料。免费备案。
(2)用途:原料药DMF属于二类DMF,作为一种参阅性资料在FDA中心档案室(Central Document Room,CDR)存档,用于一种或多种临床研究申请(IND)、创新药申请(NDA)、简化新药申请(ANDA)、出口申请、以及上述各种申请的修正和补充。
(3)法规依据:FDA并不强制要求企业递交DMF文件,相应内容也可以在制剂申请时进行提交。
(4)现状:原料药若以合法的身份进入美国市场,必须获得FDA认可。美国的DMF文件库是全世界制剂厂家广泛参照的一个供应商资源库,所以几乎所有想让产品推向国际的原料药厂都进行DMF备案。一般首先取得DMF登记号,这样,在制剂生产商向FDA提交注册申请资料时,原料药部分的资料可直接引用该原料药的DMF文件登记号,并且在现场检查时进行检查。
在FDA批准制剂申请之前,原料药生产企业必须通过FDA官员的现场检查。现场检查的目的是确认原料药生产现场是否符合ICH Q7 GMP(同时也必须符合FDA技术上的一些特殊要求);确认原料药生产现场是否与提交的DMF文件内容一致。
(5)目的:支持用户向FDA提交的各种药品申请,而同时又不愿将其化学和生产流程的保密资料抄报用户。DMF持有者只需向用户提供授权书,授权FDA在评审用户的药品申请时,对所涉及的DMF进行全面考查。
二、美国DMF申请流程
编制DMF注册文件→递交 FDA→形式审核→DMF备案号→ACTIVE活跃状态→被引用,且 FDA通知缴费后→完整性审查→可被费用列表→现场检查→通过检查→原料药生产厂商。
三、常见问题
1. 申请DMF要收费吗?
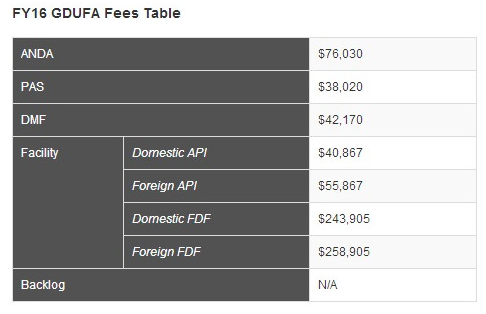
2012出台的《仿制药收费法案》,要求在2012年10月1日后首次被仿制药引用的二类原料药DMF,需要缴纳DMF费,FDA对付费后的DMF作完整性审查(Completeness Assessment),此审查只检查资料的完整性,不审核具体内容,通过完整性审查后的DMF会被收录在“可被引用”列表中,并且FDA只会审评引用此列表中DMF的ANDA申请。最新2016年度二类原料药DMF费用为$42,170,涉及到现场检查时,每年现场费用$55,867,其GDUFA的费用表如下:
2. 取得备案号就是DMF通过FDA审核了吗?
FDA只对DMF做形式审查,事实上FDA既不“审批”已备案的DMF资料,也不对DMF资料发表同意或不同意的观点。DMF资料上交后仅是编号备案。因此,在收到FDA“接收DMF通知”后,不要误认为呈交的DMF“通过了FDA审批”。
只有当DMF的用户向FDA申报制剂药品申请(IND、NDA、ANDA)及其修正或补充后,FDA才开始审查有关的DMF资料,即审查这些资料是否符合FDA的安全性及其他要求。因为DMF审查是由其用户的药品申报而引起关联性“审查”,即在授权下因申报IND、NDA、ANDA而接受审查,因此DMF资料本身不存在“批准”与“不批准”的问题。
FDA在审查中如发现DMF存在问题,FDA会向DMF持有者发函,指出欠缺之处,并同时通知药品申报者所参阅的DMF有欠缺。但FDA并不告知DMF的用户有关DMF欠缺的详细情况。对DMF的欠缺,FDA也仅仅是向DMF持有者指出而已,并不催促其改正。只要DMF存在问题,FDA是不会批准任何与其有关的药品申请的。因此,药品申报者为商业利益所迫,必然会积极地催促DMF持有者尽快改正欠缺,回复FDA。DMF持有者在改正欠缺并回复FDA后,还应立即通知用户已回复了FDA之事实,并注明回复日期。
3. 指定DMF驻美代理人是否必须?
虽然不是法定要求,但FDA强烈建议美国以外的DMF持有者指定在美国的代理人,以便于信息交流。美国境内的DMF持有者则不用指派代理人。
代理人的职权范围应在代理人指派信上明确指出。应注意的是用"指派"(Appointment)而不要用“授权”(Authorization)。“授权”仅用于呈交FDA的授权书上。DMF的代理人不同于生产商注册(Registration)和药品登记(Listing)的代理人。当指派DMF驻美代理人时,DMF持有者应在指派信上明确描述代理人姓名、地址、职权范围(行政管理和/或科学技术)。
4. DMF如何转让?
如果DMF转让他人,原DMF持有者应向新持有者提供书面转让书,并发函通知FDA该所有权的转让。通知函上应注明生效日期、提供新持有者公司的名称和地点、以及转让方负责人姓名、职务、并签字。新的DMF持有者也应向FDA发函接受DMF的转让、更新DMF信息,并承诺履行所有前任DMF持有者的责任。
5. DMF的终止的途径
(1)持有人提出申请;
(2)当超过36个月,持有人未递交年度更新报告时,FDA会发出“逾期通知信”,如果持有人未在90天内回应并递交年度更新报告,FDA会关闭该DMF.
6. 如何激活关闭的DMF?
重新递交整套符合当前规范的DMF文件,且cover letter里说明是REACTIVATION。或者持有人重新递交一份新的DMF
7. 电子递交
自2017年5月5日起,NDA, ANDA, BLA和master files都需通过eCTD递交,商业IND自2018年5月5日起通过eCTD递交。
递交通道:ESG上注册获得账户,详见说明
http://www.fda.gov/ForIndustry/ElectronicSubmissionsGateway/default.htm
8. 如何获取DUNS number?
免费获取地址http://www.dnb.com/government/duns-request/duns-request-guide.html
9. 完整性审评(Completeness Assessment)内容包括哪些?
当二类原料药DMF所有人填写仿制药费用表(FDA表格3794)并缴纳DMF费后,FDA将会对该DMF进行完整性审评,与全面的科学评估不同,完整性审评是为了确认DMF中的信息能否充分支持仿制药的注册,完整性审评的内容如下:
(1)该DMF的状态是否为活跃?
(2)费用是否缴纳?
(3)该DMF是否以前被审评过?
(4)该DMF是否只含一个活性物质?
(5)该DMF中是否含有行政信息?
(6)该DMF中的是否含有进行全面科学审评所需的所有信息?
(7)该DMF是否用英语书写?
10. DMF费用必须holder支付吗?
FDA并不关心谁来付款,DMF费用可以由ANDA的赞助方支付也可以由DMF的持有方支付。
四、久顺企管集团(中国 英国 爱尔兰)的服务流程
发出《客户资料表》→评估(电话、邮件、现场)→出具合同和计划表→签订合同→现场诊断→分析原因→美国DMF知识培训→成立DMF工作小组→讨论并制作DMF详细计划表→指导准备申报所需中文资料→制作eCTD文件等→翻译制作相关格式英文文件→递交DMF文件给FDA→指导完成相关缺陷补充→拿到DMF归档号→进行DMF年度更新→保持活跃状态→当DMF被引用时,协助客户进行完整性审核→该DMF进入可被引用列表→久顺发出cGMP符合性评估→审查软硬件状况→指导并协助客户进行整改→→组织国外专家进行原料药cGMP预审→协助迎接FDA现场检查→通过FDA现场检查。







 沪公网安备 31011502005499
沪公网安备 31011502005499