IVDD简介
CE为法文CONFORMITE EUROPEENNE的首字母缩写,表示“欧洲统一”。
CE适用区域
欧盟EU+欧洲经济区EEA+东欧,共31个国家。
很多除欧盟外的国家,除美国FDA、日本PAL、澳大利亚TGA等,绝大数通行欧洲颁发的自由销售证书CFS。
| 法国 | 德国 | 英国 | 爱尔兰 | 意大利 | 比利时 | 荷兰 | 西班牙 |
| 葡萄牙 | 卢森堡 | 瑞典 | 芬兰 | 奥地利 | 波兰 | 匈牙利 | 希腊 |
| 捷克 | 斯洛伐克 | 斯洛文尼亚 | 拉脱维亚 | 立陶宛 | 塞浦路斯 | 马耳他 | 罗马尼亚 |
| 丹麦 | 爱沙尼亚 | 保加利亚 | 冰岛 | 挪威 | 瑞士 | 土耳其 |
CE标志是一种安全认证标志,凡贴有CE标志的产品均可在欧盟各成员国内销售,无须符合各个成员国的要求。使用CE标志,实现了商品在欧盟成员国范围内的自由流通,因此CE标志被视为制造商打开并进入欧洲市场的通行证。
在欧盟市场“CE”标志属强制性认证标志,不论是欧盟内部企业生产的产品,还是其他国家生产的产品,要想在欧盟市场上自由流通,就必须加贴“CE”标志,以表明产品符合欧盟《技术协调与标准化新方法》指令的基本要求, 加贴“CE”标志必须识别很多协调标准,这是欧盟法律对产品提出的一种强制性要求。
欧盟 医疗器械指令
| 名称 | 指令 | 发布日期 | 生效日期 |
| 医疗器械指令 | 93/42/EEC,MDD | 1993-6-14 | 自1995-1-1起 |
| 体外诊断器械指令 | 98/79/EC,IVDD | 1998-10-27 | 自2000-6-7起 |
| 有源植入器械指令 | 90/385/EEC,AIMDD | 1990-6-20 | 自1993-1-1起 |
体外诊断医疗器械(in vitro diagnostic device)是指通过对取自人体的标本进行体外检查的方式来提供医疗信息的医疗器械,包括制造商指定用于体外检查从人体取得的样本,包括血液及组织供体,无论单独使用或是组合使用的任何医疗器械,可包含试剂、试剂产品、校准材料、控制材料、成 套工具、仪表、装置、设备或系统,其唯一或主要目的是提供以下信息:
--生理学或病理学状态,或;
--先天畸形状况,或;
--确定安全性以及与可能接受治疗者的相容性;或
--检测治疗措施。
另外,样本容器也被认为是体外诊断医疗器械。样本容器是指其制造商明确规定主要用于盛装和保存从人体获得的样本以作体外诊断检查的器械,无论其是否为真空型。
但是,普通实验室用的产品不属于体外诊断医疗器械,除非此类产品根据其特性是制造商明确规定用于体外诊断检查用的。
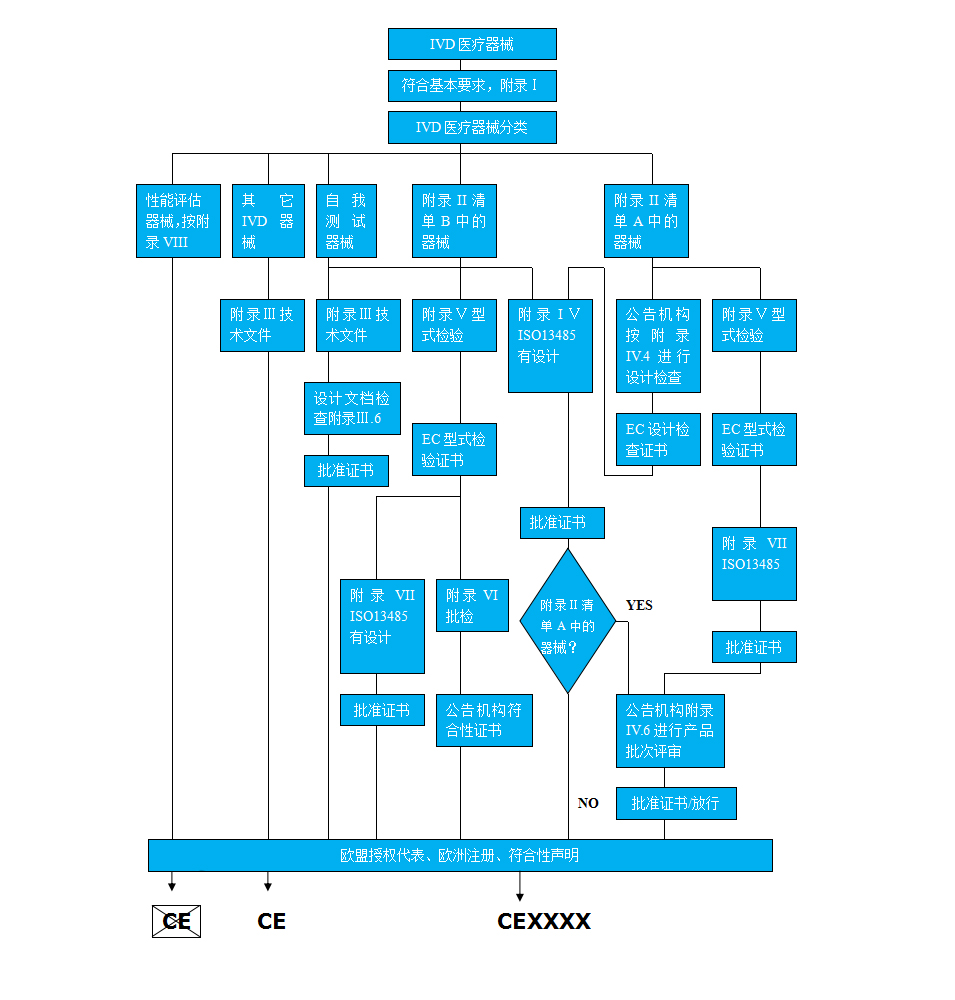
IVD管辖范围内的医疗器械,按其风险大小可以分为三个风险等级,并以清单形式列出:列于清单A中的器械风险最高,通常简称为List A;风险次之的列于清单B中,简称为List B类; 清单A、B所列之外的称为“自测器械(self-testing) ”和“其他类(Other)”,风险最低。
根据98/79/EEC 指令第9条对IVD医疗器械的符合性评估程序所做要求, List A、List B、自测 (self-testing)类器械的认证需要公告机构进行评估,其余不需要公告机构的介入。
体外诊断医疗器械CE认证的一般步骤:
步骤1. 分析该器械的特点,确定它所属的指令范围
步骤2. 确定该器械的分类(风险分级)
步骤3. 选择相应的符合性评价程序
步骤4. 选择公告机构 (适用于List A, List B和自测IVDD)
步骤5. 确认适用的基本要求/有关的协调标准
步骤6. 确认该器械满足基本要求/协调标准, 并使证据文件化
步骤7. 对于需要公告机构评审的器械,通过公告机构的符合性程序
步骤8. 起草符合性声明并加贴CE标志
IVDD CE技术文档的内容
1、目录表(版本状态,互相应用)
2、生产者的名称和地址
3、产品名称(所有的种类/型号)
产品描述(如:预期用途,各种种类/型号的清单和描述,项目号、照片、图纸)
4、器械样本的识别
5、符合性声明
6、其它文件,如证书,批准件
7、适用标准清单
8、基本要求检查表(附录1)
9、风险分析
10、产品历史(如产品的销售,投诉,产品更改)
11、生产方式(生产流程图)
12、质量控制过程(来科,过程中和最终控制)的描述,产品参数和批放行标准(原材料,元件,组件)
13、如适用,与OEM生产者的协议
15、过程验证;受控过程
16、包装信息
17、标准和使用说明书(每种一个例子)
18、微生物状态的信息
19、设计考虑(所有要求的总结)
20、稳定性研究
(单个元件/给件;稀释后/打开后;包括测试计划/测试标准)
21、软件验证
22、性能评估
23、对于清单A中的产品:符合所适用的其同技术规范
24、文献,出版物(技术,方法)
25、自我测试器械所必须的特殊要求
a.测试报告,包括非专业人员的研究
b.数据显示操作的适宜性
c.在标签和使用说明书上的信息
26、欧盟授权代表信息







 沪公网安备 31011502005499
沪公网安备 31011502005499